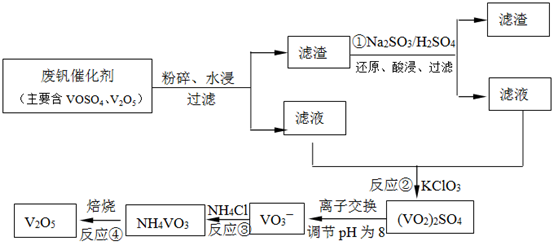
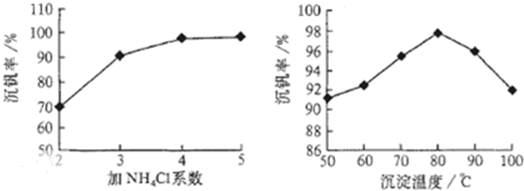
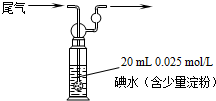
题目内容
工业上以黄铁矿为原料生产硫酸。
(1)写出燃烧黄铁矿的化学方程式 。
(2)接触室中发生反应的化学方程式是 。
(3)判断下列说法正确的是(选填序号字母) 。
a.为使黄铁矿充分燃烧,需将其粉碎
b.过量空气能提高SO2的转化率
c.使用催化剂能提高SO2的反应速率和转化率
d.沸腾炉排出的矿渣可供炼铁
(4)吸收塔中用浓硫酸吸收三氧化硫而不用水的原因是是 。
(5)吸收塔排出的尾气可以用两种方法处理:
方法①:先用氨水吸收,再用浓硫酸处理。用浓硫酸处理的主要目的是 ;
方法②:先用含一定水的亚硫酸钠吸收后再加热处理,也可达到与方法①相同的目的。为了实现节能减排,其所需能量可以由 提供。与方法①相比,方法②的优点是 。
(6)SO2 既可作为生产硫酸的原料循环再利用,也可用于工业制溴过程中吸收潮湿空气中的Br2。SO2 吸收Br2的离子方程式是 。
【答案】
(15分)(1)4FeS2+11O2
 2Fe2O3+8SO2(2分)
2Fe2O3+8SO2(2分)
(2)2SO2+O2 2SO3(2分)(3)abd(2分)
2SO3(2分)(3)abd(2分)
(4)避免形成酸雾(1分)
(5)获得较高浓度的SO2 (2分) 亚硫酸钠可以循环利用(2分) 流程前几步的废热(2分)
(6)SO2+Br2+2H2O=4H++2Br-+SO42-(2分)
【解析】略

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
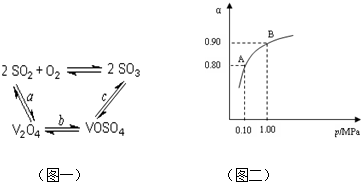
 工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题:
工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收.请回答下列个问题: