题目内容
【题目】在标准状况下,将224 L氯化氢气体溶于635 mL的水(密度为1.00 g/cm3)中,所得盐酸的密度为1.18 g/cm3。求:
(1)该盐酸的溶质质量分数是多少?______________
(2)取这种盐酸10.0 mL,稀释到1.00 L,所得的稀盐酸的物质的量浓度多少?____________
【答案】36.5%0.118 mol/L
【解析】
(1) 224 L氯化氢气体物质的量为![]() ,故HCl的质量
,故HCl的质量![]() ,水的质量为
,水的质量为![]() ,该溶液质量分数为
,该溶液质量分数为![]()
(2)该盐酸的物质的量浓度为![]()
令稀释后,所得稀盐酸的物质的量浓度为xmol/L,根据稀释定律,稀释前后溶质的物质的量不变,则0.01L×11.8mol/L=1L×xmol/L,,计算得出x=0.118mol/L。

练习册系列答案
相关题目
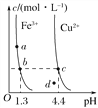
【题目】已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:

溶质的物质的量 | 溶液的密度 | |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |
(1)表中硫酸的质量分数为_____(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1mol·L-1的硫酸与水等体积混合(混合后溶液体积变化忽略不计),所得溶液的物质的量浓度为_____mol·L-1。
(3)物质的量浓度为c2mol·L-1的氨水与![]() c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____
c2mol·L-1的氨水等质量混合,所得溶液的密度_____ (填“大于”、“小于”或“等于”,下同)ρ2g·cm-3,所得溶液的物质的量浓度_____![]() c2mol·L-1(设混合后溶液的体积变化忽略不计)。
c2mol·L-1(设混合后溶液的体积变化忽略不计)。