题目内容
【题目】室温下,有关下列四种溶液的叙述正确的是(忽略溶液混合的体积变化)
① | ② | ③ | ④ | |
pH | 12 | 12 | 2 | 2 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. 在①、②中分别加入氯化铵晶体,两溶液的pH值均增大
B. 分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②
C. 把①、④两溶液等体积混合后所得溶液显酸性
D. 将溶液②和溶液③等体积混合,混合后所得溶液pH=7
【答案】B
【解析】A、氯化铵溶液中NH4+水解,溶液显酸性,所以在氨水、氢氧化钠溶液中分别加入氯化铵晶体,两溶液的pH值均减小,A不正确;B、氨水是弱碱,存在电离平衡NH3·H2O![]() NH4++OH-,稀释促进电离。氢氧化钠是强碱,完全电离,所以在pH相等的条件下,分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②,B正确;C、氨水是弱碱,因此在pH=12的条件下氨水的浓度大于0.01mol/L,因此与等体积pH=2的盐酸混合,氨水过量,溶液显碱性,C不正确;D、醋酸是弱酸,存在电离平衡CH3COOH
NH4++OH-,稀释促进电离。氢氧化钠是强碱,完全电离,所以在pH相等的条件下,分别将等体积的①和②加水稀释100倍,所得溶液的pH:①>②,B正确;C、氨水是弱碱,因此在pH=12的条件下氨水的浓度大于0.01mol/L,因此与等体积pH=2的盐酸混合,氨水过量,溶液显碱性,C不正确;D、醋酸是弱酸,存在电离平衡CH3COOH![]() CH3COO-+H+,因此在pH=2的条件下醋酸溶液的浓度大于0.01mol/L。所以与pH=12的氢氧化钠溶液等体积混合后醋酸过量,溶液显酸性,pH<7,D不正确,答案选B。
CH3COO-+H+,因此在pH=2的条件下醋酸溶液的浓度大于0.01mol/L。所以与pH=12的氢氧化钠溶液等体积混合后醋酸过量,溶液显酸性,pH<7,D不正确,答案选B。

【题目】下列有关物质元素组成的说法中错误的是( )
A. 生长激素的元素组成是C、H、O、N
B. 丙酮酸的元素组成是C、H、O
C. 脂肪的元素组成是C、H、O、N、P
D. 腺苷的元素组成是C、H、O、N
【题目】30℃时,利用下图装置进行实验,结果记录如下表所示:
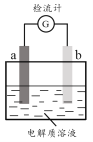
实验 | a电极 | b电极 | 电解质溶液 | 现象 |
I | Cu | Zn | 稀H2SO4 | 检流计指针向左偏转 |
II | Fe | Al | 稀H2SO4 | 检流计指针向左偏转 |
III | Fe | Al | 浓H2SO4 | 检流计指针先向左偏转,后逐渐归零,a电极表面逐渐变黑,b电极表面逐渐变白 |
IV | Fe | Al | 浓HNO3 | 检流计指针迅速向右偏转,a电极逐渐溶解,b电极表面逐渐变白 |
下列说法不正确的是( )
A. II中Al为负极,其电极反应是:Al - 3e- = Al3+
B. III中的现象说明Fe和Al表面形成致密的氧化膜,阻止了电极反应的进行
C. IV中Fe为负极,发生了氧化反应
D. 上述实验表明:相同条件下,Fe在浓HNO3中更稳定,Al在浓H2SO4中更稳定