题目内容
某温度下,0.1mol?L-1的NaHB强电解质溶液中c(H+)>c(OH-),则下列关系式正确的是 ()。A.c(Na+)=c(HB-)+2c(B2-)+c(OH-)
B.c(Na+)=0.1mol?L-1≥c(B2-)
C.c(H+)?c(OH-)=1.0×10-14
D.溶液的pH=1
B
【试题分析】
由于NaHB溶液中c(H+)>c(OH-),则存在两种情况:①NaHB为强酸的酸式盐,HB-=H++B2-,c(Na+)=c(H+)=c(B2-)=0.1mol?L-1,溶液的pH=1。②NaHB为弱酸的酸式盐,其电离程度大于其水解程度,c(Na+)=0.1mol?L-1>c(B2-),c(H+)< 0.1mol?L-1,故溶液的pH>1,故选项B正确,D错误;根据电荷守恒判断选项A错误;由于温度未指定是常温,则c(H+)?c(OH-)不一定等于1.0×10-14。故答案为B。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A、c(H+)=10-10mol?L-1 | B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) | C、c(Na+)+c(H+)=c(HCO3-)+c(OH-) | D、c(H2CO3)+c(H+)=c(CO32-)+c(OH-) |
某温度下,0.1mol·L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A.溶液中碳酸氢根电离的氢离子浓度为10-10mol·L-1 |
B.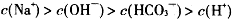 |
| C.溶液中水电离的氢氧根离子浓度为10-4mol·L-1 |
D.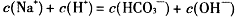 |