题目内容
某温度下,0.1mol·L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A.溶液中碳酸氢根电离的氢离子浓度为10-10mol·L-1 |
B.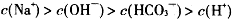 |
| C.溶液中水电离的氢氧根离子浓度为10-4mol·L-1 |
D.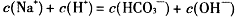 |
C
解析试题分析:A项:碳酸氢根离子水解大于电离,才呈碱性,H+主要由水电离生成的,溶液中总的氢离子浓度为10-10mol·L-1,故错;B项:OH-离子是由水解生成的,浓度很小,故错;D项:溶液中负电荷还有CO32-,故错。故选C。
考点:溶液中离子浓度的比较及计算
点评:本题考查的是水溶液中,各个离子之间浓度的关系,题目难度适中,注意基础知识的学习及应用。

练习册系列答案
 直通贵州名校周测月考直通名校系列答案
直通贵州名校周测月考直通名校系列答案
相关题目
某温度下,0.1mol?L-1NaHCO3溶液pH=10,下列判断正确的是( )
| A、c(H+)=10-10mol?L-1 | B、c(Na+)>c(OH-)>c(HCO3-)>c(H+) | C、c(Na+)+c(H+)=c(HCO3-)+c(OH-) | D、c(H2CO3)+c(H+)=c(CO32-)+c(OH-) |