题目内容
16.下列说法正确的是( )| A. | 把100mL3mol•L-1 的H2SO4跟100 mLH2O 混合,硫酸的物质的量浓度改变为1.5 mol•L-1 | |
| B. | 把200mL3mol•L-1 的BaCl2 溶液跟100mL3mol•L-1 的KCl 溶液混合后,溶液中的c(Cl-)仍然是3 mol•L-1 | |
| C. | 把100g20%的NaCl溶液跟100gH2O混合后,NaCl溶液的质量分数是10% | |
| D. | 把100mL20%的NaOH 溶液跟100mLH2O混合后,NaOH溶液的质量分数是10% |
分析 A.硫酸溶液与水混合体积不具备加合性;
B.两溶液中氯离子的浓度不相同;
C.稀释中溶质的质量不变,溶液质量变为原来2倍,根据质量分数的定义判断;
D.氢氧化钠溶液的密度与水的密度不相同.
解答 解:A.混合后溶液的体积不等于原硫酸溶液的体积与水的体积之和,故A错误;
B.3mol•L-1的BaCl2溶液中氯离子浓度为6mol•L-1,3mol•L-1的KCl溶液中氯离子浓度为L3mol•L-1,混合后氯离子浓度,介于之间3mol•L-1~6mol•L-1,故B错误;
C.100g20%的NaCl溶液中氯化钠质量为20g,稀释中溶质的质量不变,溶液质量变为原来2倍,为200g,所以混合后,NaCl溶液的质量分数是10%,故C正确;
D.氢氧化钠溶液的密度与水的密度不相同,不知道氢氧化钠溶液的密度,无法计算具体值,由于氢氧化钠的密度比水的大,根据质量分数的定义可推断混合后质量分数大于10%,故D错误;
故选C.
点评 本题考查物质的量浓度与质量分数混合计算,题目难度中等,注意溶液混合体积不具备加合性.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.能使酸性KMnO4溶液褪色的物质是( )
| A. | 醋酸 | B. | 聚乙烯 | C. | 乙醇 | D. | 苯 |
4.下列有机物命名正确的是( )
| A. | 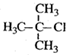 2-甲基-2-氯丙烷 | B. |  1,3,4-三甲苯 | C. | 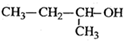 2-甲基-1-丙醇 | D. | 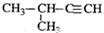 2-甲基-3-丁炔 |
1.8.12天津港特大爆炸事故现场有700吨左右氰化钠,氰化钠剧毒.有少量因爆炸冲击发生泄漏.这些泄露的氰化钠可通过喷洒氧化剂双氧水的方式来处理,以减轻污染.
(1)写出NaCN的电子式Na+ ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
(1)写出NaCN的电子式Na+
 ,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.
,偏碱性条件下,氰化钠溶液的CN-被双氧水氧化为HCO3-,同时放出NH3,该反应的离子方程式:CN-+H2O2+H2O═NH3↑+HCO3-.(2)Cu2+可作为双氧水氧化CN-中的催化剂.某兴趣小组要探究Cu2+对双氧水氧化CN-是否起催化作用,请你完成下实验方案.填写实验步骤、实验现象和结论(己知:CN-浓度可用离子色谱仪测定)
| 步骤:分别取等体积、等浓度的含氰废水于甲、乙两支试管中,再分别加入等体积、等浓度的双氧水溶液,只向甲试管中加入少量的无水硫酸铜粉末,用离子色谱仪测定相同反应时间内两支试管中的CN-浓度 | 现象与结论: 若若甲试管中的CN-浓度小于乙试管中的CN-浓度,则Cu2+对双氧水破氰反应起催化作用 若若两试管中的CN-浓度相同,则Cu2+对双氧水破氰反应不起催化作用 |
8.下列从混合物中分离出其中的某一成分,所采取的分离方法正确的是( )
| A. | 利用氯化钾与碳酸钙的溶解性差异,可用溶解、过滤的方法除去碳酸钙 | |
| B. | 由于碘在酒精中的溶解度大,所以可用酒精把碘水中的碘萃取出来 | |
| C. | 水的沸点是100℃,酒精的沸点是78.5℃,所以可用加热蒸发法使含水酒精变为无水酒精 | |
| D. | 氯化钠的溶解度随温度的下降而减小,所以可用冷却法从热的含有少量氯化钾的氯化钠浓溶液中得到纯净的氯化钠晶体 |
5.铁和铁合金是生活中常用的材料,下列说法正确的是( )
| A. | 不锈钢是铁合金,只含金属元素 | |
| B. | 生铁的含碳量比钢高 | |
| C. | 铁与盐酸反应,铁合金不与盐酸反应 | |
| D. | 铁合金的熔点低于纯铁的熔点 |
6.实验室需用90mL0.1mol/L的硫酸铜溶液,用100mL的容量瓶配制,以下配制操作正确的是( )
| A. | 称取1.44g硫酸铜,配成100mL溶液 | B. | 称取2.25g胆矾,加入100mL水 | ||
| C. | 称取1.6g硫酸,加入100mL水 | D. | 称取2.5g胆矾,配成100mL溶液 |

 .写出环己烯的一种链状的同分异构体的结构简式CH≡CH(CH2)3CH3.
.写出环己烯的一种链状的同分异构体的结构简式CH≡CH(CH2)3CH3.