��Ŀ����
����Ŀ��ﮣ�������ͭ��������Ļ���������Cu4O(PO4)2,��ͨ�����з�Ӧ�Ʊ���2Na3PO4��4CuSO4��2NH3��H2O=Cu4O(PO4)2����3Na2SO4��(NH4)2SO4��H2O.��ش��������⣺
(1)д����̬Cu2+����Χ�����Ų�ʽ��__________.C��N��O����Ԫ�صĵ�һ��������С�����˳��Ϊ__________(��Ԫ�ط��ű�ʾ).
(2)PO43���Ŀռ乹����____________________________________________.
(3)��������ͭ�ķ��ӽṹ��ͼ,����̼ԭ�ӵ��ӻ���ʽΪ______________.

(4)����ͭ����Ҫ�Ľ���,Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ������.�������������[Fe(CN)6]4���в�����___________________.
A.���ۼ� B.�Ǽ��Լ� C.��λ�� D.���� E.����
(5)������ͭ��Һ�м��������ˮ,��������������İ���ͭ����,��д���İ���ͭ���ӵĽṹʽ_________.
(6)NaCl��������r(Na��)=a pm,r(Cl��)=b pm,��NaCl�����Ŀռ�������Ϊ________.(�������������ܶѻ���ʽ����,�ú���a,b����ʽ��ʾ)
���𰸡�3d9 C��O��N �������� sp3��sp2 B 
![]()
��������
��1��ͭ��29��Ԫ�أ�����ͭ���Ӻ�����27�����ӣ����ݹ���ԭ��д�����������Ų�ʽ����ȷ������Χ�����Ų�ʽ������Ԫ�������ɱȽϵ��һ�����ܣ�
��2�����ݼ۲���ӶԻ�������ȷ����ռ乹�ͣ�
��3���ɰ�������ͭ��̼ԭ�ӵļ۲�������ֱ�Ϊ4��3����ȷ�����ӻ���ʽ��
��4����[Fe(CN)6]4���У�һ��CN���к���1��������2���м�����ÿ��CN-��Fe������λ�����ϣ�
��5��Cu����ԭ�ӣ�NH3�����壬ȷ����ṹʽ��
��6��NaCl����Ϊ���������ܶѻ������ı߳�Ϊ��2a+2b��pm�������Na+��Cl-��ռ����;���������Ӷ�������ռ���������
��1��ͭ��29��Ԫ�أ�����ͭ���Ӻ�����27�����ӣ����ݹ���ԭ��֪�����������Ų�ʽΪ��[Ar]3d9������Χ�����Ų�Ϊ3d9��ͬһ�����У�Ԫ�صĵ�һ����������ԭ�������������������VA��Ԫ�صĵ�һ�����ܴ���������Ԫ�أ�����C��N��OԪ�ص�һ������ΪC��O��N��
�ʴ�Ϊ��3d9��C��O��N��
��2��PO43����Pԭ�ӵļ۲���Ӷ�=4+![]() ��5+3��4��2��=4��Pԭ��Ϊsp3�ӻ����Ҳ����µ��Ӷԣ�������ռ乹���������壬
��5+3��4��2��=4��Pԭ��Ϊsp3�ӻ����Ҳ����µ��Ӷԣ�������ռ乹���������壬
�ʴ�Ϊ���������壻
��3����������ͭ�ķ����У�������һ��̼��̼��˫�������۲������Ϊ3������̼���ӻ���ʽΪsp2�ӻ�����һ��̼��Χ���ǵ��������۲������Ϊ4����̼���ӻ���ʽΪsp3�ӻ���
�ʴ�Ϊ��sp3��sp2��
��4����[Fe(CN)6]4���У�һ��CN���к���1��������2���м���C��N�Dz�ͬ��ԭ������Ϊ���Լ�����֮��Ϊÿ��CN����Fe������λ�����ϣ�
�ʴ�Ϊ��B��
��5����ΪCu����ԭ�ӣ�NH3�����壬����ȷ��ṹʽΪ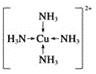 ��
��
�ʴ�Ϊ�� ��
��
��7�������й�����4��Na+��4����4��Cl�������Ϊ![]() �У�a3+b3����4�������ı߳�Ϊ2a+2b���������Ϊ��2a+2b��3���Ȼ��ƾ��������ӵĿռ�������Ϊ��
�У�a3+b3����4�������ı߳�Ϊ2a+2b���������Ϊ��2a+2b��3���Ȼ��ƾ��������ӵĿռ�������Ϊ��![]() 100%=
100%=![]() ��
��
�ʴ�Ϊ��![]() ��
��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�����Ŀ��X��Y��Z��W���ֶ�����Ԫ�أ��й��������±�������������ȷ���ǣ� ��
Ԫ�ش��� | X | Y | Z | W |
ԭ�Ӱ뾶/pm | 66 | 70 | 143 | 160 |
��Ҫ���ϼ� | -2 | +5��+3��-3 | +3 | +2 |
A. W��Y�γɵĻ�����Ϊ���ۻ�����
B. Y������������Ӧ��ˮ����Ϊǿ��
C. Y�ļ���̬�⻯��ķе����X�ļ���̬�⻯��
D. ��ҵ�Ͼ������õ��Z���Ȼ�����Һ�Ʊ�Z����