题目内容
【题目】常温下,向20.00mL0.1000mol/L(NH4)2SO4溶液中逐滴加入0.2000mol/LNaOH溶液时,溶液的pH与所加NaOH溶液体积的关系如下图所示(不考虑挥发)。下列说法正确的是
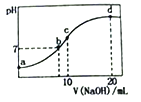
A. 点a所示溶液中:c(NH4+)>c(SO42-)>c(OH-)>c(H+)
B. 点b所示溶液中: c(NH4+)=c(Na+)> c(H+)= c(OH-)
C. 点c所示溶液中:c(NH3·H2O)+ c(OH-)= c(H+)+ c(SO42-)
D. 点d所示溶液中: c(SO42-)> c(NH3·H2O)> c(OH-)> c(NH4+)
【答案】C
【解析】a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH-),铵根离子水解程度较小,结合物料守恒知c(NH![]() )>c(SO
)>c(SO![]() ),所以溶液中离子浓度大小顺序是c(NH
),所以溶液中离子浓度大小顺序是c(NH![]() )>c(SO
)>c(SO![]() )>c(H+)>c(OH-),A错误;b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH
)>c(H+)>c(OH-),A错误;b点溶液中,溶液呈中性,则c(H+)=c(OH-),根据电荷守恒得c(H+)+c(NH![]() )+c(Na+)=2c(SO
)+c(Na+)=2c(SO![]() )+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH
)+c(OH-),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH![]() )>c(Na+),B错误;c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH
)>c(Na+),B错误;c点溶液中,溶液呈碱性,所以c(H+)<c(OH-),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH![]() )+c(Na+)=2c(SO
)+c(Na+)=2c(SO![]() )+c(OH-),根据物料守恒得,根据物料守恒得c(NH
)+c(OH-),根据物料守恒得,根据物料守恒得c(NH![]() )+c(NH3·H2O)=2c(SO
)+c(NH3·H2O)=2c(SO![]() )=2c(Na+),所以得c(SO
)=2c(Na+),所以得c(SO![]() )+c(H+)=c(NH3·H2O)+c(OH-),C正确;d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3·H2O)>c(SO
)+c(H+)=c(NH3·H2O)+c(OH-),C正确;d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3·H2O)>c(SO![]() ),D错误;正确选项C。
),D错误;正确选项C。

【题目】按如图装置进行实验,下列推断正确的是( )

选项 | Ⅰ中试剂 | Ⅱ中试剂及现象 | 推断 |
A | 氯化铵 | 酚酞溶液不变红色 | 氯化铵稳定 |
B | 硫酸亚铁 | 品红溶液褪色 | FeSO4分解生成FeO和SO2 |
C | 涂有石蜡油的碎瓷片 | 酸性高锰酸钾溶液褪色 | 石蜡油发生了化学变化 |
D | 铁粉与水蒸气 | 肥皂水冒泡 | 铁粉与水蒸气发生了反应 |
A. A B. B C. C D. D
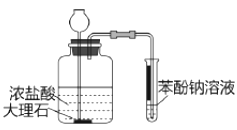
【题目】下列实验方案中,能达到相应实验目的的是( )
实验方案 |
|
|
|
|
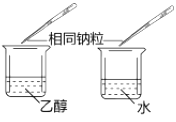
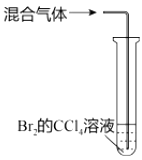
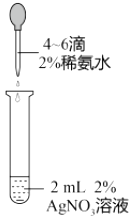
目的 | A.比较乙醇分子中羟基氢原子和水分子中氢原子的活泼性 | B.除去乙烯中的二氧化硫 | C.制银氨溶液 | D.证明碳酸酸性强于苯酚 |
A.A
B.B
C.C
D.D