题目内容
对于铜和稀硝酸的反应:Cu+HNO3(稀)--Cu(NO3)2+NO↑+H2O
(1)配平并用双线桥标出电子得失的数目与方向 .
(2)氧化剂是 ,氧化产物是 ,氧化剂与还原剂的物质的量之比是 .
(3)若有19.2g Cu被氧化,则被还原的HNO3的质量为多少?
(1)配平并用双线桥标出电子得失的数目与方向
(2)氧化剂是
(3)若有19.2g Cu被氧化,则被还原的HNO3的质量为多少?
考点:氧化还原反应
专题:氧化还原反应专题
分析:该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,所以铜是还原剂、部分硝酸是氧化剂,还原剂发生氧化反应、氧化剂发生还原反应,以此来解答.
解答:
解:(1)该反应中Cu元素化合价由0价变为+2价、部分N元素化合价由+5价变为+2价,其得失电子最小公倍数是6,
用双线桥标出该反应电子转移的方向和数目为 ,
,
故答案为: ;
;
(2)该反应中Cu元素失电子被氧化,该反应中铜是还原剂,则氧化产物是Cu(NO3)2,N元素得到电子,则HNO3为氧化剂,由电子守恒可知氧化剂与还原剂的物质的量之比是
=2:3,故答案为:HNO3;Cu(NO3)2;2:3;
(3)若有19.2g Cu被氧化,n(Cu)=
=0.3mol,则被还原的硝酸为0.3mol×
=0.2mol,其质量为0.2mol×63g/mol=12.6g,答:被还原的HNO3的质量为12.6g.
用双线桥标出该反应电子转移的方向和数目为
 ,
,故答案为:
 ;
;(2)该反应中Cu元素失电子被氧化,该反应中铜是还原剂,则氧化产物是Cu(NO3)2,N元素得到电子,则HNO3为氧化剂,由电子守恒可知氧化剂与还原剂的物质的量之比是
| (2-0) |
| (5-2) |
(3)若有19.2g Cu被氧化,n(Cu)=
| 19.2g |
| 64g/mol |
| 2 |
| 3 |
点评:本题考查了氧化还原反应,为高频考点,注意从元素化合价变化来分析解答,能用双线桥标出电子转移的方向和数目,侧重分析与计算能力的综合考查,题目难度不大.

练习册系列答案
相关题目
燃烧下列混合气体,所产生的CO2的量一定小于燃烧相同质量的丙烯所产生的CO2的是( )
| A、丁烯、丙烯 |
| B、乙炔、乙烯 |
| C、乙炔、丙烷 |
| D、乙烯、丙烷 |
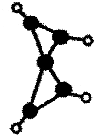 科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( )
科学家最近在-100℃的低温下合成一种烃X,此分子的模型如图(图中的连线表示化学键),下列说法正确的是( )| A、X是一种在常温下能稳定存在的液态烃 |
| B、X能使溴的四氯化碳溶液褪色 |
| C、X分子中在同一平面上的碳原子最多5个 |
| D、X的一氯取代物有四种 |
下列微粒既具有氧化性又具有还原性的是( )
①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-.
①Al3+ ②Cl- ③N2 ④MnO4- ⑤CO2 ⑥H2O2 ⑦Fe2+ ⑧MnO42-.
| A、①④⑤⑦ | B、③⑥⑦⑧ |
| C、④⑤⑥⑧ | D、①②③⑥ |