题目内容
【题目】(1)科研人员设想用如图所示装置生产硫酸。
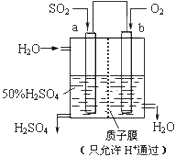
①上述生产硫酸的总反应方程式为____,b是____极(填“正”或“负”),b电极反应式为_____,a电极发生_____。(填“氧化反应”或“还原反应”)
②生产过程中H+向___(填 a 或 b)电极区域运动。
(2)将两个铂电极插入氢氧化钾溶液中,向两极分别通入甲烷和氧气,可构成甲烷燃料电池,已知通入甲烷的一极,其电极反应式为:_______,该燃料电池总反应式为:_____ ,电池在放电过程中溶液的pH将______(填“下降”或“上升”、“不变”)。
【答案】2SO2+O2+2H2O=2H2SO4 正 O2+4e-+4H+=2H2O 氧化反应 b CH4+10OH--8e-=CO32-+7H2O CH4+2O2+2OH-=CO32-+3H2O 下降
【解析】
(1)根据图像可知,该装置为原电池装置,a为电池的负极,二氧化硫失电子生成硫酸根离子;b为电池的正极,氧气得电子,与质子反应生成水;
(2)甲烷燃料电池,甲烷为电池的负极,氧气为电池的正极;
(1)①根据图像上述总反应为二氧化硫与氧气和水反应生成硫酸,反应式为:2SO2+O2+2H2O=2H2SO4;b为电池的正极,电极反应式为:O2+4e-+4H+=2H2O;a为负极,失电子,化合价升高,被氧化,发生氧化反应;
②电池工作时,内电路中阳离子向正极移动,则氢离子向b极移动;
(2)甲烷燃料电池,甲烷为电池的负极,甲烷失电子与溶液中的氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH4+10OH--8e-=CO32-+7H2O;正极为:O2+4e-+2H2O =4OH-,得失电子总数相等时两式相加,总反应为:CH4+2O2+2OH-=CO32-+3H2O,消耗溶液中的氢氧根离子,pH值下降;

 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案【题目】分离提纯下列物质时选用的试剂或方法不正确的是
分离提纯 | 试剂 | 方法 | |
A | 除去Cl2中的HCl | NaOH溶液 | 洗气 |
B | 提取溴水中的溴单质 | CCl4 | 萃取 |
C | 除去SiO2中的Fe2O3 | 稀盐酸 | 过滤 |
D | 除去乙醇中的水 | 无水CuSO4 | 蒸馏 |
A.AB.BC.CD.D
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有1 mL浓硫酸的试管中加人5 mL 0 .1 mol/L的K2 Cr2 O7溶液 | 溶液橙 色变深 | 增大生成物浓度,平衡Cr2 O |
B | 向Mg(OH)2悬浊液中加人少量醋酸铵晶体 | 沉淀溶解,溶液变澄清 | 说明反应Mg2++2NH3·H2O |
C | 相同温度下,同时向①4mL0.1 mol/L. KMnO4),酸性溶液和②4 mL 0.2 mol/LKMnO4,酸性溶液中,分别加人4mL 1 mol/L. H2 C2 O4溶液 | ①中溶液先褪色 | 该实验条件下,KMnO4浓度越小,反应速率越快 |
D | 向煤炉中灼热的煤炭上洒少量水 | 产生淡蓝色火焰煤炭燃烧更旺 | 加少量水后,可使煤炭燃烧放出更多的热量 |
A. A B. B C. C D. D
