题目内容
1.对于${\;}_{19}^{40}$K原子,下列叙述不正确的是( )| A. | 原子核内质子数为19 | B. | 原子核外电子数为19 | ||
| C. | 质量数为40 | D. | 中子数为40 |
分析 原子符号左上角是质量数,左下角是质子数,再根据中子数=质量数-质子数,核外电子数=质子数进行判断.
解答 解:A.左下角是质子数质子数为19,故A正确;
B.核外电子数=质子数=19,故B正确;
C.原子符号左上角是质量数,质量数为40,故C正确;
D.中子数=质量数-质子数=40-19=21,故D错误.
故选D.
点评 本题考查原子符号的意义,难度不大.了解原子符号的意义和粒子数之间的关系是解题的关键.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目
11.设NA表示阿伏加德罗常数值,下列叙述正确的是( )
| A. | 5.6g铁与足量氯气完全反应时失去的电子数目为0.2NA | |
| B. | 标准状况下,11.2L H2中含有的电子数为1NA | |
| C. | 标准状况下,2.24 L水中含有水分子0.1 NA | |
| D. | 2L1mol/L的盐酸中所含氯化氢分子数为2NA |
12.下列叙述中正确的是( )
| A. | 14C可用于文物的年代鉴定,14C与13C互为同素异形体 | |
| B. | 最外层电子数为2的元素一定是金属元素 | |
| C. | 过渡元素一定是金属元素 | |
| D. | 同一周期中的第ⅡA族和第ⅢA族元素的原子序数差一定为1或11 |
9.已知1~18号元素的离子aXm+、bY n+、cZP-、dWk-都具有相同的电子层结构,下列关系正确的是( )
| A. | 若P>K,则还原性cZP-<dWk- | |
| B. | 若m>n,则碱性 X(OH)m>Y(OH)n | |
| C. | 若半径aXm+>bYn+,则a<b | |
| D. | 若半径aXm+>bY n+,则X的单质一定能从含Yn+的盐溶液中置换出Y |
16.下列反应中,属于吸热反应的是( )
| A. | 活泼金属跟酸反应 | B. | 煤气燃烧 | ||
| C. | 酸碱中和反应 | D. | 工业制生石灰 |
6.下列反应一定属于取代反应的是( )
| A. | 2Na+2H2O═2NaOH+H2↑ | B. | CH3CH=CH2+Br2→CH3CHBrCH2Br | ||
| C. | CH4+Br2 $\stackrel{光}{→}$CH3Br+HBr | D. | a-b+c-d═a-c+b-d |
13.1998年山西朔州发生假酒案,假酒中严重超标的有毒成份主要是( )
| A. | 丙三醇 | B. | 甲醛 | C. | 乙二醇 | D. | 甲醇 |
10.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是( )
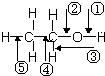

| A. | 和金属钠作用时,键①断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和浓氢溴酸共热时,键②和③断裂 | |
| D. | .在铜催化下和氧气反应时,键①和③断裂 |
11.下表是不同温度下水的离子积的数据:
试回答以下问题:
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
(1)若25<t1<t2,则a>1×10-14(填“>”、“<”或“=”),做此判断的理由是温度升高,水的电离程度增大,离子积增大.
(2)25℃时,某Na2SO4溶液中c(SO42-)=5×10-4 mol•L-1,取该溶液1mL加水稀释至10mL,则稀释后溶液中c(Na+):c(OH-)=1 000:1.
(3)在t2温度下测得某溶液pH=7,该溶液显碱(填“酸”、“碱”或“中”)性,将此温度下pH=11的NaOH溶液a L与pH=1的H2SO4溶液b L混合,若所得混合液pH=2,则a:b=9:11.