题目内容
【题目】下表为元素周期表的一部分,①~⑩代表10种短周期元素。

请参照元素①~⑩在表中的位置,回答下列问题:
【1】表中属于金属元素的共有 种。
A.2B.3C.5D.8
【2】推测元素③和⑦的非金属性强弱
A.③>⑦B.③<⑦C.③=⑦D.不确定
【3】表中元素化学性质最不活泼的是
A.①B.④C.⑤D.⑩
【4】元素⑨在周期表中的位置为
A.第三周期第七主族B.第三周期第ⅦA族
C.第二周期第七副族D.第三周期第ⅦB族
【5】元素①、③和④形成的化合物
A.一定是共价化合物B.一定是离子化合物
C.可能是共价化合物也可能是离子化合物D.无法判断
【答案】
【1】A
【2】A
【3】D
【4】B
【5】C
【解析】
由元素在元素周期表中的位置可知,①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Si、⑧为S、⑨为Cl、⑩为Ar。
1. 表中⑤为Na、⑥为Al,二者属于金属元素;
2. 同周期自左而右非金属性增强,同主族自上而下非金属性减弱;
3. 稀有气体原子最外层为稳定结构,化学性质稳定;
4. 由位置可知元素⑨在周期表中的位置为:第三周期第ⅦA族;
5. H、N、O形成的化合物有HNO3、NH4NO3等。
【1】表中⑤为Na、⑥为Al,只有这2种元素属于金属元素,故合理选项是A。
【2】同一周期的元素从左到右,随着原子序数的增大,元素的非金属性逐渐增强;同一主族从上到下,元素的非金属性逐渐减弱,故元素的非金属性:③>⑦,故合理选项是A。
【3】⑩为稀有气体Ar,Ar原子最外层为8个电子稳定结构,化学性质最不活泼,故合理选项是D。
【4】元素⑨是Cl元素,根据元素的原子结构与元素在周期表的位置关系可知元素⑨在周期表中位于第三周期第ⅦA族,故合理选项是B。
【5】H、N、O形成的化合物有HNO3、NH4NO2、NH4NO3等,HNO3属于共价化合物,分子中只有共价键,而NH4NO2、NH4NO3属于离子化合物,物质中既含有离子键也含有共价键,故合理选项是C。
本题考查元素周期表与元素周期律,注意根据元素在周期表中的位置确定常见元素的种类,并会分析物质的性质及性质变化规律,本题旨在考查学生对基础知识的掌握。

【题目】工业上常以闪锌矿(主要成分ZnS,含Fe、Cu、Cd等元素的杂质)为原料,通过火法或湿法炼锌,两种方法都是先将闪锌矿焙烧得到以ZnO为主要成分的焙砂,再分别制得锌。具体流程如下:
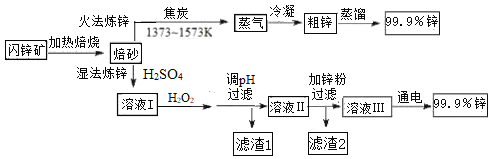
已知:
Fe3+ | Zn2+ | Cu2+ | Fe2+ | Cd2+ | |
开始沉淀的pH | 1.1 | 5.9 | 4.7 | 7.6 | 6.9 |
沉淀完全的pH | 3.2 | 8.1 | 6.7 | 9.6 | 9.7 |
(1)火法炼锌涉及的主要反应:
2C(s) + O2(g) = 2CO(g) H=﹣220 kJ· mol-1
2ZnS(s) + 3O2(g) = 2ZnO(s) + 2SO2(g) H=﹣930 kJ· mol-1
ZnO(s) + CO(g) = Zn(g) + CO2(g) H= +198 kJ· mol-1
则ZnS(s) + 2O2(g) + C(s) = Zn(g) +CO2(g) + SO2(g) 的H=_______________。
(2)湿法炼锌工艺中加入双氧水的目的是____________,调节pH的范围是________,滤渣1的成分是___________(写化学式),滤渣2的成分是___________(写化学式)。
(3)含锌废液是造成环境污染的重要原因之一。
①已知氢氧化锌和氢氧化铝性质相似。向电解后废液中加入稍过量的KOH溶液(假设其他物质不与碱反应),发生反应的离子方程式是_______________。
②一种生产锌的新技术碱浸—电解法的原理是:将ZnO溶于KOH溶液得到四羟基合锌酸钾[K2Zn(OH)4]溶液,再电解该溶液即获得金属锌。用石墨电极电解时阴极的反应式是___________。