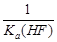题目内容
(8分)重晶石(主要成分是BaSO4)是制备钡化合物的重要原料,但BaSO4不溶于水也不溶于酸,这给转化为其他钡盐带来了困难,工业上用饱和Na2CO3溶液处理BaSO4沉淀,待达到平衡后,移走上层清夜,重复多次操作,将其转化为易溶于酸的BaCO3,再由BaCO3制备其它钡盐。
Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式: ,此反应平衡常数K的值为 。
(2)要实现该转化C(CO32-)不低于 mol/L
(3)必须更换Na2CO3溶液的原因是什么?
Ksp(BaSO4)=1.0×10-10 Ksp(BaCO3)=5.0×10-10
(1)写出沉淀转化的方程式: ,此反应平衡常数K的值为 。
(2)要实现该转化C(CO32-)不低于 mol/L
(3)必须更换Na2CO3溶液的原因是什么?
(1)BaSO4(s)+Na2CO3(aq)=BaCO3(s)+Na2SO4(aq);0.2
(2)2.5×10-4mol/L (3)保证Na2CO3溶液的浓度不低于2.5×10-4mol/L
(2)2.5×10-4mol/L (3)保证Na2CO3溶液的浓度不低于2.5×10-4mol/L
(1)根据反应物和生成物可写出方程式为
BaSO4(s)+Na2CO3(aq)=BaCO3(s)+Na2SO4(aq)。
反应的平衡常数是 。
。
(2)饱和硫酸钡溶液中,SO42-浓度是5×10-5mol/L,所以此时CO32-浓度是5×10-5mol/L÷0.2=2.5×10-4mol/L。
(3)要使沉淀转化,则必须保证Na2CO3溶液的浓度不低于2.5×10-4mol/L。
BaSO4(s)+Na2CO3(aq)=BaCO3(s)+Na2SO4(aq)。
反应的平衡常数是
 。
。(2)饱和硫酸钡溶液中,SO42-浓度是5×10-5mol/L,所以此时CO32-浓度是5×10-5mol/L÷0.2=2.5×10-4mol/L。
(3)要使沉淀转化,则必须保证Na2CO3溶液的浓度不低于2.5×10-4mol/L。

练习册系列答案
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案
相关题目