题目内容
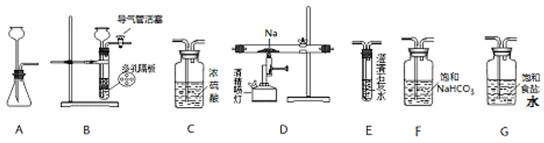
(15分)某化学兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
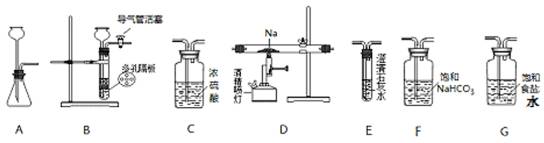
请回答下列问题:
(1)选择必要的仪器,按___________________________顺序连接好装置(填装置序号)。
(2)检验装置B气密性的方法:__________________________________。
(3)实验时,在点燃酒精喷灯前必须进行的操作是______________________,待装置E中出现_____________现象时,再点燃酒精喷灯,以上操作的目的是___________________。
(4)加热一段时间后观察到钠块表面变黑,继续加热后,钠燃烧,有白烟生成。两种产物中有一种是重要的化工原料,在玻璃工业中用量很大。则钠与二氧化碳反应的化学方程式是______________。
(5)上述实验生成的黑色物质与浓硫酸在一定条件下反应会生成一种大气污染物,可利用酸性KMnO4溶液来测定该气体在空气中的含量,反应的离子方程式__________________;判定反应是否需要指示剂(如果需要,选择何种指示剂,请描述现象。如果不需要,请说明理由。)_______ ____________________________________。
(15分)(1)B、F、C、D、(C)、E(2分)[注:有无(C)均给分]
(2)塞紧双孔塞,关闭活塞,由长颈漏斗向试管内加水,到漏斗内液面超过试管内液面,形成一段液柱停止加水,一段时间后液柱不下降,证明装置气密性良好(2分)。
(3)打开装置B中导气管活塞(或通入CO2)(2分) 澄清的石灰水变浑浊(1分)
排出装置中的空气(2分)
(4)4Na + 3CO2 2Na2CO3 +
C (2分)
2Na2CO3 +
C (2分)
(5)5SO2 + 2MnO4- + 2H2O = 2Mn2+ + 5SO42-+ 4H+(2分) 不需要指示剂(1分),因为反应中MnO4-→Mn2+溶液由紫红色变成无色,可以指示终点(1分)。
【解析】(1)由于钠易和水蒸气反应,而制取的CO中含有水蒸气和氯化氢,所以在和钠反应之前,需要进行除杂,因此正确的连接顺序是B、F、C、D、(C)、E。
(2)装置B是简易启普发生器,所以检验气密性的方法是塞紧双孔塞,关闭活塞,由长颈漏斗向试管内加水,到漏斗内液面超过试管内液面,形成一段液柱停止加水,一段时间后液柱不下降,证明装置气密性良好。
(3)由于装置中含有空气,而在加热的条件下,钠极易被氧气氧化,所以在点燃酒精喷灯前必须进行的操作是排尽装置中的空气,方法是打开装置B中导气管活塞(或通入CO2),当空气排尽后,CO2能使澄清的石灰水变混浊,据此可以判断。
(4)在玻璃工业中用量很大的是碳酸钠,钠块表面变黑,说明还有碳生成,所以方程式为4Na + 3CO2 2Na2CO3 + C。
2Na2CO3 + C。
(5)碳和浓硫酸反应生成的大气污染物是SO2,SO2具有还原性,能被酸性高锰酸钾溶液氧化,生成硫酸,方程式为5SO2 + 2MnO4- + 2H2O = 2Mn2+ + 5SO42-+ 4H+。由于酸性高锰酸钾溶液显紫红色,而生成物锰离子是无色的,所以不需要指示剂。