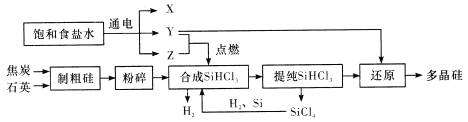
��Ŀ����
����Ŀ���Ӻ�ˮ�п�����ȡ�ܶ����õ����ʣ�����Ӻ�ˮ�������õ���±ˮ�п�����ȡ�⡣����̿�������ǹ�ҵ���ķ���֮һ�����������£�

������ʾ����. pH=2ʱ��NaNO2��Һֻ�ܽ� I������ΪI2��ͬʱ����NO
��. I2+5Cl2+6H2O === 2HIO3+10HCl
��. 5SO32��+2IO3��+2H+===I2+5SO42��+H2O
��1����Ӧ�ٵ����ӷ���ʽ____________________��
��2���������У�����I2�����ԣ��������X�ķ�����____________��
��3����֪����Ӧ����ÿ����3mol I2ת��5mol���ӣ����ӷ���ʽ��__________��
��4��Cl2������KMnO4�ȶ��dz��õ�ǿ�����������ù���������±ˮ�е�I��ȴѡ���˼۸�ϸߵ�NaNO2��ԭ����_______________________��
��5���������У���֪��Ӧ�۹��˺���Һ���Դ���������I2��I����IO3�������ֱ�������Һ�е�I����IO3������ʵ�鷽������������ʵ���пɹ�ѡ����Լ���ϡH2SO4��������Һ��Fe2(SO4)3��Һ��Na2SO3��Һ
a.��Һ��CCl4�����ȡ����Һ��ֱ��ˮ���õ�����Һ���鲻���ⵥ�ʴ��ڡ�
b._____________________��
���𰸡� 2NO2��+2 I��+4H+===I2+2NO +2H2O ��������ȡ������ᾧ���������ᾧ���۷֣� 3 I2+3CO32��===5 I��+ IO3��+3CO2 ��3 I2+6 CO32��+3H2O===5 I��+ IO3��+6HCO3�� ���������Ը�����صȶ��dz��õ�ǿ�����������������I2(���������ƽ��ܰѵ����������ɵⵥ��,��˼�Լ���) ��ˮ��ȡ������Һ���Թ��У����뼸�ε�����Һ���μ�Fe2(SO4)3��Һ������Һ������˵����Һ�к���I��������ˮ����ȡ������Һ���Թ��У����뼸�ε�����Һ���������ữ���μ�Na2SO3��Һ������Һ������˵����Һ�к���IO3��
����������1����Ӧ��ΪpH=2ʱ��NaNO2��Һ�� I������ΪI2��ͬʱ����NO�����䷴Ӧ�����ӷ���ʽΪ��2NO2��+2 I��+4H+===I2+2NO +2H2O����2������I2�����������ԣ��������X�ķ�������������ȡ������ᾧ����3��������֪��������Ӧ����ÿ����3mol I2ת��5mol���ӣ������������ԭ��Ӧ�е�ʧ������Ϊ5����0������Ϊ+5�ۺʹ�0�۽���Ϊ-1�ۣ��������ӷ���ʽ�ǣ�3I2+3CO32��=5I��+ IO3��+3CO2 ��3I2+6 CO32��+3H2O=5I��+ IO3��+6HCO3������4��Cl2������KMnO4�ȶ��dz��õ�ǿ�����������ù���������±ˮ�е�I��ȴѡ���˼۸�ϸߵ�NaNO2��ԭ�������������Ը�����صȶ��dz��õ�ǿ�����������������I2���Ӷ��ò���I2����5��������Һ�е�I������ѡ���������������������ĵⵥ�������۱�����������Һ�е�IO3�������û�ԭ�����仹ԭ�����ⵥ�������۱������Ӷ��ü죬�ʷ���Ϊ����ˮ��ȡ������Һ���Թ��У����뼸�ε�����Һ���μ�Fe2(SO4)3��Һ������Һ������˵����Һ�к���I��������ˮ����ȡ������Һ���Թ��У����뼸�ε�����Һ���������ữ���μ�Na2SO3��Һ������Һ������˵����Һ�к���IO3����

 �����Ծ���ĩ���100��ϵ�д�
�����Ծ���ĩ���100��ϵ�д� ˫��ͬ������ѵ��ϵ�д�
˫��ͬ������ѵ��ϵ�д� �Ƹ�С״Ԫͬ������������ϵ�д�
�Ƹ�С״Ԫͬ������������ϵ�д�����Ŀ����֪��2KMnO4��5H2C2O4��3H2SO4��K2SO4��2MnSO4��10CO2����8H2O��
ij��ѧС�����������Ӧԭ����������ʵ�飺
�����ⶨH2C2O4��Һ�����ʵ���Ũ��
ʵ�鲽�����£�
��ȡ����H2C2O4��Һ25.00mL������ƿ�У��ټ���������ϡ���
����0.1mol��L��1KMnO4��Һ�ζ����յ㣬��¼���ݣ�
���ظ��ζ�2�Σ�ƽ������KMnO4��Һ20.00mL��
��ش�
��1���ζ�ʱ����KMnO4��Һװ��________��������ʽ��������ʽ�����ζ����С�
��2�����ڲ���������֮ǰ�����ô���H2C2O4��Һ��ϴ��ƿ������H2C2O4��Һ��Ũ�Ȼ�________������ƫ������ƫС��������Ӱ��������
��3���������е���ζ��յ�ʱ������Ϊ________��
��4������H2C2O4��Һ�����ʵ���Ũ��Ϊ________mol��L��1��
����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ���������ʵ�鷽����ʵ���¶Ⱦ�Ϊ25������
ʵ����� | ���V��mL | |||
0.1mol��L��1KMnO4��Һ | 0.1mol��L��1H2C2 O4��Һ | 0.1mol��L��1H2SO4��Һ | H2O | |
�� | 2.0 | 5.0 | 6.0 | 7.0 |
�� | 2.0 | 8.0 | 6.0 | V1 |
�� | 2.0 | V2 | 6.0 | 2.0 |
��ش�
��5������V1��________��V2��________��
��6��ʵ������Ҫ������������________��
��7��ʵ����________������������������������0.2mol��L��1�������0.1mol��L��1H2SO4��Һ��������________��