题目内容
以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸铵和氧化铁红颜料,原料的综合利用率较高。其主要流程如下: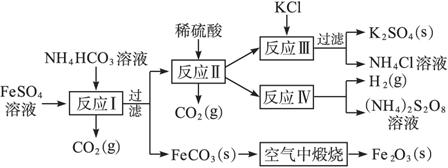
(1)反应Ⅰ前需在FeSO4溶液中加入_______________(填字母),以除去溶液中的Fe3+。
A.锌粉 B.铁屑
C.KI溶液D.H2
(2)反应Ⅰ需控制反应温度低于
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是_______________。
(4)反应Ⅳ常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_______________。
(1)B
(2)防止NH4HCO3分解(或减少Fe2+的水解)
(3)降低K2SO4的溶解度,有利于K2SO4析出
(4) ![]() -2e-====
-2e-====![]()
解析:(1)除去Fe3+时注意不能引入新的杂质;
(2)温度高,NH4HCO3易分解,Fe2+易水解;
(3)操作Ⅲ要得到K2SO4固体,由此可知是为了降低K2SO4的溶解度,有利于K2SO4的析出。
(4)电解时阳极发生氧化反应,产物为(NH4)2S2O3,所以阳极电极反应为![]() -2e-====
-2e-====![]() 。
。

(A)(12分) 工业上以氯化钾和钛白厂的副产品硫酸亚铁为原料可得到硫酸钾、过二硫酸钠和铁红颜料等产品,该方法原料的综合利用率较高。
(1)基态钛原子的核外电子排布式为 ▲ 。
(2)TiCl4在常温下是一种无色液体,而FeCl3可用升华法提纯,则两种氯化物均属于 ▲ 晶体。
(3)SO42-和 S2O82-(过二硫酸根)结构中,硫原子均位于由氧原子组成的四面体的中心,且所有原子的最外层电子均满足8电子结构。下列说法正确的是 ▲ 。
A.SO42-中存在σ键和π键且与PO43-离子互为等电子体
B.S2O82-中存在非极性键且有强氧化性
C.S2O82-比SO42- 稳定且两者的氧元素的化合价相同
(4)KCl与MgO的晶体结构跟NaCl的晶体结构相似,则KCl与MgO两者中熔点高的是 ▲ ,原因是 ▲ 。
(5)硫与氯可形成化合物SCl2,则该分子中硫原子的杂化方式为 ▲ ,分子的空间构型为 ▲ 。
(6)在一定条件下铁形成的晶体的基本结构单元如下图1和图2所示,则图1和图2的结构中铁原子的配位数之比为 ▲ 。



