题目内容
在通常条件下,下列各组物质的性质排列正确的是( )
| A、熔点:HF>HCl>HBr | B、水溶性:HCl>CO2>SO2 | C、沸点: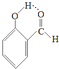 > >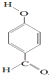 | D、热稳定性:HCl>H2S>PH3 |
分析:A.HF中含氢键,熔点高,HCl、HBr的相对分子质量越大,熔点越大;
B.HCl极易溶于水,CO2、SO2均与水反应,但CO2为非极性分子,SO2为极性分子;
C. 含分子间氢键,沸点高;
含分子间氢键,沸点高;
D.非金属性越强,气态氢化物越稳定.
B.HCl极易溶于水,CO2、SO2均与水反应,但CO2为非极性分子,SO2为极性分子;
C.
 含分子间氢键,沸点高;
含分子间氢键,沸点高;D.非金属性越强,气态氢化物越稳定.
解答:解:A.HF中含氢键,熔点高,HCl、HBr的相对分子质量越大,熔点越大,则熔点为HF>HBr>HCl,故A错误;
B.HCl极易溶于水,CO2、SO2均与水反应,但CO2为非极性分子,SO2为极性分子,则水溶性为HCl>SO2>CO2,故B错误;
C. 含分子间氢键,则沸点为
含分子间氢键,则沸点为 <
< ,故C错误;
,故C错误;
D.非金属性Cl>S>P,则气态氢化物稳定性为HCl>H2S>PH3,故D正确;
故选D.
B.HCl极易溶于水,CO2、SO2均与水反应,但CO2为非极性分子,SO2为极性分子,则水溶性为HCl>SO2>CO2,故B错误;
C.
 含分子间氢键,则沸点为
含分子间氢键,则沸点为 <
< ,故C错误;
,故C错误;D.非金属性Cl>S>P,则气态氢化物稳定性为HCl>H2S>PH3,故D正确;
故选D.
点评:本题考查熔沸点比较及稳定性比较,为高频考点,把握氢键、分子晶体熔点比较方法及非金属性与气态氢化物稳定性的关系为解答的关键,侧重基础知识的考查,题目难度不大.

练习册系列答案
 期末1卷素质教育评估卷系列答案
期末1卷素质教育评估卷系列答案
相关题目
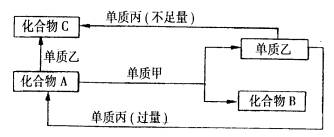
 A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
A、B、C是中学化学中常见的无机物,且各由两种元素组成;甲、乙、丙是三种常见的单质;这些化合物和单质间存在如图所示转化关系(这些转化关系都不需要使用催化剂),回答下列问题:
 (2012?琼海一模)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如图(部分反应产物已略去).
(2012?琼海一模)已知A为中学化学中的一种盐,B、C为日常生活中常见的金属.通常条件下D、G为无色无味气体.已知用惰性电极电解A溶液一段时间后,产物只有C、D和E的稀溶液.各物质之间的转化关系如图(部分反应产物已略去).