题目内容
18.标准状况下,10.8g CO和CO2混合气体的体积是6.72L,则此混合气体中,CO和CO2的物质的量之比是1:1,CO的质量分数为38.9%.分析 混合气体的物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,根据混合气体物质的量、质量计算二者物质的量之比,根据m=nM计算CO质量,由此计算CO质量分数.
解答 解:混合气体的物质的量=$\frac{6.72L}{22.4L/mol}$=0.3mol,CO和CO2的物质的量分别是xmol、ymol,
则$\left\{\begin{array}{l}{x+y=0.3}\\{28x+44y=10.8}\end{array}\right.$
解得:$\left\{\begin{array}{l}{x=0.15}\\{y=0.15}\end{array}\right.$
所以CO和CO2的物质的量之比=0.15mol:0.15mol=1:1;
CO质量分数=$\frac{0.15mol×28g/mol}{10.8g}×100%$=38.9%,
故答案为:1:1;38.9%.
点评 本题考查物质的量有关计算,为高频考点,侧重考查学生分析计算能力,利用质量、物质的量计算即可,熟练掌握物质的有关公式.

练习册系列答案
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案
相关题目
9.下列说法正确的是( )
| A. | 利用外接直流电源保护铁质建筑物,属于电化学中牺牲阳极的阴极保护法 | |
| B. | 碰撞理论和过渡态理论是常用的反应速率理论,其中过渡态理论可解释温度、催化剂等对反应速率的影响 | |
| C. | 人们通常用标准燃烧热或热值来衡量燃料燃烧放出热量的大小,其中标准燃烧热是指101kPa下,1g物质完全燃烧的反应热 | |
| D. | 改变影响化学平衡的一个因素,平衡将向着能够减弱这种改变的方向移动 |
6.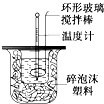 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:
①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度. 回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
②近似认为0.55mol/L NaOH溶液和0.25mol/L硫酸溶液的密度都是1g/cm3,中和后生成溶液的比热容c=4.18J/(g•℃).则中和热△H=-56.8kJ/mol ( 取小数点后一位).
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)a、b、c.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
 利用如图装置测定中和热的实验步骤如下:
利用如图装置测定中和热的实验步骤如下:①用量筒量取50mL 0.25mol/L硫酸倒入小烧杯中,测出硫酸温度;
②用另一量筒量取50mL 0.55mol/L NaOH溶液,并用另一温度计测出其温度;
③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测出混合液最高温度. 回答下列问题:
(1)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热数值为57.3kJ/mol):$\frac{1}{2}$H2SO4(aq)+NaOH(aq)═$\frac{1}{2}$Na2SO4(aq)+H2O(l)△H=-57.3kJ•mol-1.
(2)倒入NaOH溶液的正确操作是:C. (从下列选项中选出).
A.沿玻璃棒缓慢倒入 B.分三次少量倒入C.一次迅速倒入
(3)实验数据如下表:
①请填写下表中的空白:
| 温度 实验 次数 | 起始温度t1℃ | 终止温度t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
| H2SO4 | NaOH | 平均值 | |||
| 1 | 26.2 | 26.0 | 26.1 | 29.5 | |
| 2 | 27.0 | 27.4 | 27.2 | 32.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.2 | |
| 4 | 26.4 | 26.2 | 26.3 | 29.8 | |
③上述实验数值结果与57.3kJ/mol有偏差,产生偏差的原因可能是(填字母)a、b、c.
a.实验装置保温、隔热效果差
b.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中.
13.在强酸性溶液,下列离子组能大量共存且溶液为无色透明的是( )
| A. | Na+ K+ OH- Cl- | B. | Na+ Cu2+ SO42- NO3- | ||
| C. | Mg2+ Na+ SO42- Cl- | D. | Ba2+ HCO3- NO3- K+ |
10.下列反应既属于吸热反应又属于氧化还原反应的是( )
| A. | 铁与稀硫酸反应 | B. | 灼热的碳与CO2的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl的反应 | D. | 乙烷在氧气中的燃烧反应 |
7.下列物质能使干燥的蓝色石蕊试纸先变红后褪色的是( )
①氯气 ②盐酸 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸酸化的漂白粉溶液.
①氯气 ②盐酸 ③新制氯水 ④氯气的酒精溶液 ⑤盐酸酸化的漂白粉溶液.
| A. | ③⑤ | B. | ③④⑤ | C. | ①②③ | D. | ①③④ |
8.下表是几种弱酸常温下的电离平衡常数:
(1)若把CH3COOH、H2CO3、HCO3-、H2S、HS-、H3PO4、H2PO4-、HPO42-都看成酸,则酸性最强的是H3PO4,最弱的是HPO42-.
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在温度相同时,各弱酸的K值不同,K值越大酸越强(填“强”或“弱”).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-不能(填“能”或“不能”,下同) H2CO3+HS-能.
| CH3COOH | H2CO3 | H2S | H3PO4 |
| 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=9.1×10-8 K2=1.1×10-12 | K1=7.5×10-3 K2=6.2×10-8 K3=2.2×10-13 |
(2)多元弱酸的二级电离程度远小于一级电离的原因是一级电离产生的H+对二级电离有抑制作用.
(3)同浓度的CH3COO-、HCO3-、CO32-、S2-结合H+的能力由强到弱的顺序为S2->CO32->HCO3->CH3COO-.
(4)在温度相同时,各弱酸的K值不同,K值越大酸越强(填“强”或“弱”).
(5)根据K值大小判断下列反应能否发生:CH3COOH+H2PO4-不能(填“能”或“不能”,下同) H2CO3+HS-能.