题目内容
对于Zn(s)+H2SO4(l)==ZnSO4(l)+H2(g);ΔH <0 的化学反应下列叙述不正确的是
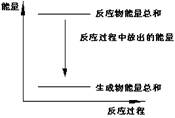
- A.反应过程中能量关系可用上图表示
- B.ΔH的值与反应方程式的计量系数有关
- C.若将该反应设计成原电池锌为负极
- D.若将其设计为原电池当有32.5g锌溶解时,正极F放出气体一定为11.2L
D
根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应。而锌与稀硫酸的反应是就是放热反应,所以选项A正确。反应热和化学计量数有关系,B正确。该反应是氧化还原反应,所以能设计成原电池,C正确。32.5g锌失去32.5g÷65g/mol×2=1.0mol,所以生成氢气是0.5mol,但体积不一定是11.2L,选项D不正确,答案选D。
根据图像可知,反应物的总能量高于生成物的总能量,所以是放热反应。而锌与稀硫酸的反应是就是放热反应,所以选项A正确。反应热和化学计量数有关系,B正确。该反应是氧化还原反应,所以能设计成原电池,C正确。32.5g锌失去32.5g÷65g/mol×2=1.0mol,所以生成氢气是0.5mol,但体积不一定是11.2L,选项D不正确,答案选D。

练习册系列答案
相关题目




