题目内容
2.常温下,在400mL稀氢氟酸中,投入一颗石英玻璃,2.5min后,溶液质量减少了11.22g,此时SiF4为气体,则这段时间内用HF表示该反应的平均化学反应速率为1.02mol/(L?min).分析 依据化学方程式定量关系计算消耗的HF物质的量,结合反应速率V(HF)=△c△t△c△t计算.
解答 解:常温下,在400mL稀氢氟酸中,投入一颗石英玻璃,2.5min后,溶液质量减少了11.22g.此时SiF4为气体,
SiO2+4HF=SiF4↑+2H2O△m
4mol 44g
n 11.22g
n=1.02mol
用HF表示该反应的平均化学反应速率=1.02mol0.4L2.5min1.02mol0.4L2.5min=1.02mol/(L•min),
故答案为:1.02 mol/(L?min).
点评 本题考查了化学反应速率概念的计算应用,主要是化学方程式定量计算的分析,掌握基础是关键,题目较简单.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案
相关题目
13.最近,科学家研制出一种纸质电池,这种“软电池”采用薄层纸片作为载体和传导体,在一边附着锌,在另一边附着二氧化锰.电池总反应为:Zn+2MnO2+H2O=ZnO+2MnO(OH).下列说法正确的是( )
| A. | 该电池Zn为负极,ZnO为正极,MnO2为催化剂 | |
| B. | 导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn | |
| C. | 该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH- | |
| D. | 电池工作时正极发生氧化反应 |
17.下列反应中,反应后固体物质增重的是( )
| A. | 高温灼烧CuO固体 | B. | 二氧化碳通过Na2O2粉末 | ||
| C. | 硫粉与铁粉混合加热 | D. | 将金属Cu投入FeCl3溶液中 |
7.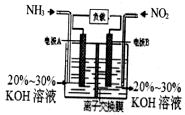 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
5.钛及其合金具有许多优异的性能.具有超导特性、形状记忆和吸氧特性等,而被称为“太空金属”和“海洋金属”,在航空航天、海洋开发、化工、冶金、汽车等领域有着越来越广泛的用途.
(1)Ti(BH4)2是一种过渡元素硼氢化物材料,基态钛原子外围电子构型为3d24s2;在Ti(BH4)2中钛元素化合价为+2,与Ti(BH4)2中的阴离子互为等电子体CH4.(写一种即可)
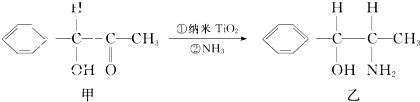
(2)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示,化合物甲的分子中采取sp2方式杂化的碳原子数为7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为C<O<N.
(3)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如表:
KCl、CaO、TiN三种离子晶体熔点由高到低的顺序是为CaO>NaCl>KCl.
(4)Ti3+可形成配位数为6的配合物,现有钛的两种颜色的配合物,一种为紫色,另一种为绿色.相关实验证明,两种晶体的组成皆为TiCl3•6H2O.为测定这两种配合物的成键情况,
设计了如下实验:分别取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀;测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的2323.则原绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
(5)有一种氮化钛晶体的晶胞和氯化钠晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为apm,则该氧化钛的密度为62×4(2a×10−10)3NAg/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.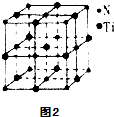
(1)Ti(BH4)2是一种过渡元素硼氢化物材料,基态钛原子外围电子构型为3d24s2;在Ti(BH4)2中钛元素化合价为+2,与Ti(BH4)2中的阴离子互为等电子体CH4.(写一种即可)
(2)纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如图1所示,化合物甲的分子中采取sp2方式杂化的碳原子数为7个,化合物乙中采取sp3方式杂化的原子对应的元素的电负性由大到小的顺序为C<O<N.

(3)科学家通过X-射线探明KCl、MgO、CaO、TiN的晶体与NaCl的晶体结构相似,且知三种离子晶体的晶格能数据如表:
| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |
(4)Ti3+可形成配位数为6的配合物,现有钛的两种颜色的配合物,一种为紫色,另一种为绿色.相关实验证明,两种晶体的组成皆为TiCl3•6H2O.为测定这两种配合物的成键情况,
设计了如下实验:分别取等质量的两种物质的样品配成待测溶液,分别往待测溶液中滴入过量的AgNO3溶液并充分反应,均产生白色沉淀;测定沉淀质量并比较,发现原绿色物质得到的沉淀质量由原来紫色物质得到沉淀质量的2323.则原绿色晶体配合物的化学式为[TiCl(H2O)5]Cl2•H2O.
(5)有一种氮化钛晶体的晶胞和氯化钠晶胞相似,如图2所示,该晶胞中N、Ti之间的最近距离为apm,则该氧化钛的密度为62×4(2a×10−10)3NAg/cm3(NA为阿伏伽德罗常数的数值,只列计算式).该晶体中与N原子距离相等且最近的N原子有12个.

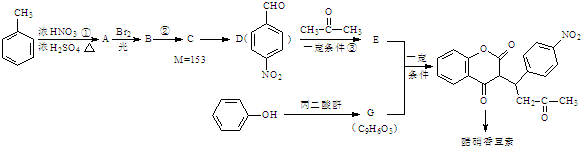
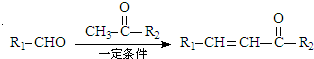 +H2O
+H2O .
. .
.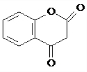 .
.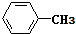 互为同系物;
互为同系物;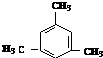 .
.
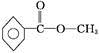 .
. ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.