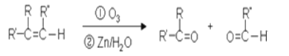
题目内容
【题目】工业上用CO和H2生产燃料甲醇(CH3OH)。一定条件下密闭容器中发生反应,测得数据曲线如图所示(反应混合物均呈气态)。下列说法错误的是
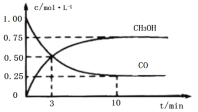
A.反应的化学方程式:CO+2H2CH3OH
B.反应进行至3分钟时,正、逆反应速率相等,反应达到平衡状态
C.反应至10分钟,CO的转化率为75%
D.反应至3分钟,用甲醇来表示反应的平均速率为![]() mol/(L·min1)
mol/(L·min1)
【答案】B
【解析】
A.由图可知,反应至10分钟达到平衡状态,△c(CO)=1mol/L0.25mol/L=0.75mol/L,△c(CH3OH)=0.75mol/L0=0.75mol/L,△c(CO):△c(CH3OH)=1:1,根据原子守恒可知,反应的化学方程式:CO+2H2![]() CH3OH,故A不符合题意;
CH3OH,故A不符合题意;
B.反应进行至3分钟时,并没有达到化学平衡状态,因此正、逆反应速率不相等,故B符合题意;
C.反应至10分钟时,△c(CO)=1mol/L0.25mol/L=0.75mol/L,CO的转化率![]() ,故C不符合题意;
,故C不符合题意;
D.反应至3分钟,甲醇的平均反应速率![]() ,故D不符合题意;
,故D不符合题意;
故答案为:B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目