题目内容
 (08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
(08上海松江区模拟)乙酸乙酯是重要的工业原料和溶剂。现利用如图
装置制取乙酸乙酯粗产品,再测定乙酸乙酯的含量。
⑴写出此反应的化学方程式
;
该反应要在浓硫酸存在的条件下进行,浓硫酸的作用是
;
⑵实验室一般用饱和碳酸钠溶液接收反应的生成物。若不
振荡该试管,可看到的现象是 ,若振
荡该试管,可看到的现象是 ,但有时却出现了白色晶体,该晶体是 ;
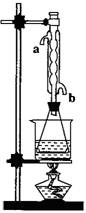 ⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
⑶对于制乙酸乙酯的上述装置,为了提高产率,请提出
一条改进意见:
。
⑷为测定乙酸乙酯的含量,进行了如下操作:
(I)准确称量20.0g乙酸乙酯粗品于锥形瓶中,用0.50mol/L
NaOH滴定(酚酞做指示剂)。终点时消耗NaOH溶液的体积为
40.0mL;
(II)另取20.0g乙酸乙酯粗产品于250mL锥形瓶中,加入100mL
2.1mol/LNaOH溶液混合均匀后,装上冷凝管,在水浴上加热回
流约1小时,装置如图所示。待冷却后,用0.50mol/LHCl滴定
过量的NaOH。终点时消耗盐酸的体积为20.0mL。
回答:
①实验(I)中达到滴定终点时的现象是 。
②实验(II)中冷水从冷水凝管的 (填a或b)管口通入。
③利用实验(I)、(II)测量的数据计算粗产物中乙酸乙酯的质量分数为 。
答案:(1)CH3COOH + C2H5OH ![]() CH3COOC2H5 + H2O (2分)
CH3COOC2H5 + H2O (2分)
催化 吸水 (1分)
(2)液体分为两层 无色气泡 NaHCO3(各1分,共3分)
(3)水浴加热、加装温度计、用圆底烧瓶代替试管等(合理就给分)(2分)
(4)溶液由无色恰好变为浅红色,并在半分钟内不褪色 (1分) b (1分)
79.2%(2分)

 阅读快车系列答案
阅读快车系列答案2(08浙江省开化中学模拟)实验室中根据2SO2+O2![]() 2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
2SO3;ΔH=-393.2 kJ?mol-1设计如下图所示实验装置来制备SO3固体。请回答下列问题。
 |
(1)实验前,必须进行的操作是(填操作名称,不必写具体过程)
(2)在A装置中加入Na2SO3固体的同时,还需加几滴水,然后再滴加浓硫酸。加几滴水的作用是
(3)小试管C的作用是
(4)广口瓶D内盛的试剂是 。装置D的三个作用是 ①
② ③
(5)实验中当Cr2O3表面红热时,应将酒精灯移开一会儿再加热,以防温度过高,这样做的原因是
(6)装置F中U型管内收集到的物质的颜色、状态是
(7)装置G的作用是
(8)从G装置导出的尾气处理方法是
(08皖南8校第三次联考)1 L某混合溶液,可能含有的离子如下表:
可能大量还有的阳离子 |
|
可能大量还有的阴离子 |
|
 (1)往该溶液中逐滴加入
(1)往该溶液中逐滴加入![]() 溶液并适当
溶液并适当
加热,产生沉淀和气体的物质的量(![]() )
)
与加入![]() 溶液的体积(V)的关系
溶液的体积(V)的关系
如右图所示。则该溶液中确定含有的离子
有_______________;不能确定是否含有
的阳离子有______________,要确定其存
在可补充做的实验是___________;肯定不存在的阴离子有_________________。
(2)经检测,该溶液中含有大量的![]() ,若向1 L该混合溶液中通入―定晕的
,若向1 L该混合溶液中通入―定晕的![]() ,溶液中
,溶液中![]() 的物质的量与通入
的物质的量与通入![]() 的体积(标准状况)的关系如下表所示,分析后回答下列问题:
的体积(标准状况)的关系如下表所示,分析后回答下列问题:

 (08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
(08安徽信息卷)2008年北京奥运会体现“人文奥运”的一个重要举措是坚决反对运动员服用兴奋剂。利尿酸足一种被禁止使用的药物,其结构简式如图所示。下列有关利尿酸说法正确的是()
 溶液发生显色反应
溶液发生显色反应 。下列说法正确的是()
。下列说法正确的是() A.a极为电池的正极
A.a极为电池的正极
 厍仑的电量
厍仑的电量  ①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g)△H1=+49.0KJ/mol