��Ŀ����
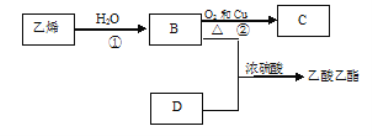
����Ŀ�����ȵ�̿��Ũ����ɷ�����Ӧ��
��1��д���û�ѧ��Ӧ����ʽ��������˫����������÷�Ӧ�е��ӵ�ת�Ƶķ������Ŀ___��
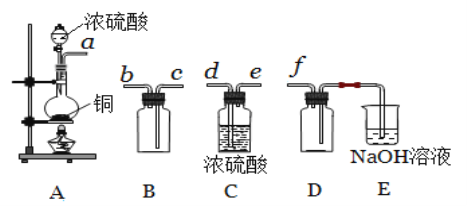
��2���������һ��ʵ������֤�˷�Ӧ�����ɵĸ��ֲ��ʵ���пɹ�ʹ�õ��Լ��У�Ũ���ᡢϡ���ᡢ����ʯ��ˮ��NaOH��Һ��Ʒ����Һ�����Ը��������Һ����ˮ����ͭ����ͼ�ʯ�ҡ���һ��ͬѧ��������������������һ��ʵ����̣�����ʹ�õ��Լ�����ɱ�ʾΪ������������Լ������Լ������Լ������Լ������Լ���
���Լ����ֱ�Ϊ___��___��___��___��
��˵���Լ���ʹ�����ε����÷ֱ���___��___��
��д���������ͨ���Լ���ʱ�����ӷ���ʽ___��
���𰸡� ��ˮ����ͭ���� Ʒ����Һ ����KMnO4��Һ ����ʯ��ˮ ��������������Ƿ���SO2 ȷ��SO2�����ѱ����� Ca2����CO2��2OH����CaCO3����H2O
��ˮ����ͭ���� Ʒ����Һ ����KMnO4��Һ ����ʯ��ˮ ��������������Ƿ���SO2 ȷ��SO2�����ѱ����� Ca2����CO2��2OH����CaCO3����H2O
��������
(1)ľ̿��Ũ������ȷ�Ӧ���ɶ�����������̼��ˮ��
(2)��֤̼��Ũ���ᷴӦ�IJ�����Ҫ����֤���ɵ�ˮ��������ˮ����ͭ����ɫ˵������ˮ������֤����������ʹƷ����Һ��ɫ����ȥ�������������Ʒ����Һ�����Ƿ����������ó���ʯ����֤������̼��
��1�����ȵ�̿��Ũ���ᷢ����ӦC��2H2SO4��Ũ��![]() CO2����2SO2����2H2O����Ӧ��CԪ�ػ��ϼ���0�����ߵ�+4�ۣ�ʧ���ӱ�������SԪ�ػ��ϼ���+6�۽��͵�+4�ۣ��õ��ӱ���ԭ�����ϼ۱仯����С������Ϊ4������ӵ�ת�Ʒ������Ŀ�ɱ�ʾΪ
CO2����2SO2����2H2O����Ӧ��CԪ�ػ��ϼ���0�����ߵ�+4�ۣ�ʧ���ӱ�������SԪ�ػ��ϼ���+6�۽��͵�+4�ۣ��õ��ӱ���ԭ�����ϼ۱仯����С������Ϊ4������ӵ�ת�Ʒ������Ŀ�ɱ�ʾΪ ��
��
(2)��֤̼��Ũ���ᷴӦ�IJ�����Ҫ����֤���ɵ�ˮ��������ˮ����ͭ����ɫ˵������ˮ������֤����������ʹƷ����Һ��ɫ����ȥ�������������Ʒ����Һ�����Ƿ����������ó���ʯ����֤������̼;���Ե�һ��ʹ�ö�������ʱ�������Ǽ����Ƿ���SO2���ɣ��ڶ���ʹ�ö�������������Ǽ���SO2�Ƿ�������Լ�IVΪ������̼�ͳ���ʯ��ˮ������Ӧ����̼��Ƴ�����ˮ��
���Լ�I���� ��IV�ֱ�Ϊ����ˮ����ͭ��Ʒ����Һ�����Ը�����ء�����ʯ��ˮ��
��˵���Լ�IΪƷ����Һ��ʹ�����ε����÷ֱ��ǵ�һ��ʹ��ʱ�������Ǽ����Ƿ���SO2���ɣ��ڶ���ʹ�õ������Ǽ���SO2�Ƿ������
���������ͨ���������Լ�IVʱ������Ӧ����̼��ƺ�ˮ����Ӧ�����ӷ���ʽΪ��CO2+Ca2+ +2OH-=CaCO3��+H2O��

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�