题目内容
A─E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
B | 该单质为生活中常见的金属,其相对原子质量比A大8 |
C | 地壳中含量最多的金属元素 |
D | 元素的主族序数是其所在周期序数的3倍 |
E | E的某种原子的原子核内没有中子 |
(1)请写出A在元素周期表中的位置__________________;C单质与强碱溶液反应的离子方程式是____________ _。
(2)①在高温条件下,将D、E组成的气态化合物与A 的粉末充分反应,生成8g E的单质和相应的固态化合物时,放出a kJ 热量,此反应的热化学方程式是____________________________________________________________。
② A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是 ____。
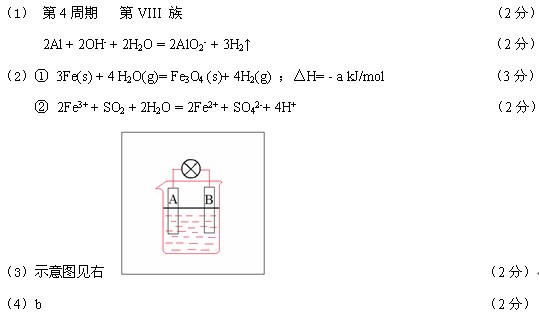
 (3)已知化学反应 A + 2E+ = A2+ + E2 能自发进行,若将上述A、B两种金属,插入含大量E+ 的电解质溶液的烧杯中,可组成原电池。请在右侧方框内相应位置上画出烧杯等,完成原电池电极与用电器连接的示意图。
(3)已知化学反应 A + 2E+ = A2+ + E2 能自发进行,若将上述A、B两种金属,插入含大量E+ 的电解质溶液的烧杯中,可组成原电池。请在右侧方框内相应位置上画出烧杯等,完成原电池电极与用电器连接的示意图。
(4)向2 mL 0.5mol/L的ACl3溶液中加入3 mL 3mol/LKF溶液,ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(已知氧化性Fe3+>I2)
a. A3+不与I-发生反应 b. A3+ 与F-结合生成不与I-反应的物质
c. F- 使I-的氧化性减弱 d. A3+被 F-还原为A2+,使溶液中不再存在A3+
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案(8分)A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,则下列说法正确的是(已知氧化性Fe3+>I2)
(填字母)。
a. A3+不与I-发生反应 b. A3+与F-结合生成不与I-反应的物质
c. F-使I-的氧化性减弱 d. A3+被F-还原为A2+,使溶液中不再存在A3+
(10分)A―E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
(1)请写出A在元素周期表中的位置 ;C单质在强碱溶液反应的离子方程式是 。
![]() (2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和 ②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是 。
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和 ②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是 。
![]() (3)已知化学反应A+2E+=A2++E2能自发进行,若将上述A、
(3)已知化学反应A+2E+=A2++E2能自发进行,若将上述A、
![]() B两种金属,插入含大量E+的电解质溶液的烧杯中,
B两种金属,插入含大量E+的电解质溶液的烧杯中,
![]() 可组成原电池。如图。
可组成原电池。如图。
B为_______极,电极反应式为________
(10分)A―E五种元素中,除A、B外其他均为短周期元素,它们的性质或原子结构如下表:
元素 | 元素性质或原子结构 |
A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
B | 单质为生活中常见的金属,其相对原子质量比A大8 |
C | 地壳中含量最多的金属元素 |
D | 元素的主族序数是其所在周期序数的3倍 |
E | E的某种原子的原子核内没有中子 |
(1)请写出A在元素周期表中的位置 ;C单质在强碱溶液反应的离子方程式是
(2)①在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和 ②A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离 子方程式是 。
子方程式是 。
(3)已知化学反应A+2E+=A2++E2能自发进行,若将上述A、B两种金属,插入含大量E+的电解质溶液的烧杯中,可组成原电池。如图。B为_______极,电极反应式为________
A—E五种元素中,除A、B外其他均为短周期元素它们的性质或原子结构如下表:
| 元素 | 元素性质或原子结构 |
| A | 单质为生活中常见的金属,该金属的两种黑色氧化物(其中一种有磁性)的相对分子质量相差160 |
| B | 单质为生活中常见的金属,其相对原子质量比A大8 |
| C | 地壳中含量最多的金属元素 |
| D | 元素的主族序数是其所在周期序数的3倍 |
| E | E的某种原子的原子核内没有中子 |
(1)在高温条件下,将D、E组成的气态化合物与A的粉末充分反应,生成8gE的单质和相应的固态化合物时,放出a KJ热量,此反应的热化学方程式是
(2)A的某种氯化物溶液呈黄色,向其中通入足量SO2气体,溶液变为浅绿色,此反应的离子方程式是
(3)向2mL 0.5mol/L的ACl3溶液中加入3mL 3mol/L KF溶液,
ACl3溶液褪成无色,再加入KI溶液和CCl4振荡后静置,CCl4层不显色,
则下列说法正确的是(已知氧化性Fe3+>I2) (填字母)。
a. A3+不与I-发生反应 b. A3+与F-结合生成不与I-反应的物质
c. F-使I-的氧化性减弱 d. A3+被F-还原为A2+,使溶液中不再存在A3+