题目内容
2. 水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸(
水杨酸甲酯又叫冬青油,是一种重要的有机合成原料.某化学小组用水杨酸( )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.实验步骤:
Ⅰ.如图,在三颈烧瓶中加入6.9g (0.05mol)水杨酸和24g(30mL,0.75mol)甲醇,向混合物中加入约10mL甲苯(甲苯与水形成的共沸物,沸点为85℃,该实验中加入甲苯,易将水蒸出),再小心地加入5mL浓硫酸,摇动混匀,加入1~2粒沸石,组装好实验装置,在85~95℃下恒温加热反应1.5小时:
Ⅱ.待装置冷却后,分离出甲醇,然后转移至分液漏斗,依次用少量水、5%NaHCO3 溶液和水洗涤;分出的产物加入少量无水MgSO4固体,过滤得到粗酯;
Ⅲ.将粗酯进行蒸馏,收集221℃~224℃的馏分,得水杨酸甲酯4.5g.
常用物理常数:
| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
(1)仪器A的名称是球形冷凝管,制备水杨酸甲酯时,最合适的加热方法是水浴加热.
(2)实验中加入甲苯对合成水杨酸甲酯的作用是反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率.
(3)反应结束后,分离甲醇的操作是蒸馏(或水洗分液).
(4)洗涤操作中,第一次水洗的主要目的是洗掉大部分的硫酸,第二次水洗的主要目的是洗掉碳酸氢钠.
(5)检验产品中是否含有水杨酸的化学方法是向产品中滴加少量的紫色石蕊试液,观察是否变红.
(6)本实验的产率为59%(保留两位有效数字).
分析 (1)根据题中仪器A的构造判断该仪器的名称;控制温度在85~95℃下恒温下加热反应,需要温度计控制水浴温度加热;
(2)根据题意可知“该实验中加入甲苯,易将水蒸出”,水在低温下挥发,同时减少了甲醇的消耗;
(3)根据物质的溶解性来解答;
(4)在洗涤操作中,第一次洗涤的主要目的是除去大部分催化剂硫酸;第二次水洗,主要目的是除去产品中残留的碳酸氢钠;
(5)根据酸能使紫色石蕊试液变红来解答;
(6)先根据水杨酸和甲醇的物质的量,然后判断过量情况,根据不足量计算出理论上生成水杨酸甲酯的物质的量,最后根据实际上制取的水杨酸甲酯计算出产率.
解答 解:(1)由装置中仪器A的构造可知,仪器A的名称是球形冷凝管,使挥发出来的气体冷凝回流;控制温度在85~95℃下恒温下加热反应,温度低于100℃,应采取水浴加热;
故答案为:球形冷凝管;水浴加热;
(2)该实验中加入甲苯,易将水蒸出,反应产生的水从反应体系中分离开来,使得平衡向右移动,水在低温下挥发,同时减少了甲醇的消耗,从而提高反应的产率;
故答案为:反应产生的水从反应体系中分离开来,使得平衡向右移动,同时可以减少甲醇的用量,从而提高反应的产率;
(3)甲醇和水杨酸甲酯是互溶的液体,可用蒸馏来分离;甲醇易溶于水,水杨酸甲酯不溶于水,可以水洗来分离,故答案为:蒸馏(或水洗分液);
(4)反应后的溶液要经过多次洗涤,在洗涤操作中,第一次水洗的主要目的是除去大部分催化剂硫酸,5%NaHCO3溶液既可以除去未洗净的硫酸,也可以降低酯的溶解度,但第二步洗涤后生成的酯中混有NaHCO3,所以第二次水洗,主要目的是除去产品中残留的碳酸氢钠,
故答案为:洗掉大部分硫酸;洗掉碳酸氢钠;
(5)水杨酸呈酸性,所以向产品中滴加少量的紫色石蕊试液,观察是否变红即可,故答案为:向产品中滴加少量的紫色石蕊试液,观察是否变红;
(6)水杨酸和甲醇的物质的量分别为:0.05mol,0.75mol,由于水杨酸和甲醇是按照1:1进行反应,所以甲醇过量,生成水杨酸甲酯的量要按照水杨酸的物质的量计算,即理论上生成0.05mol水杨酸甲酯;实际上生成的水杨酸甲酯的质量为4.5g,物质的量为:$\frac{4.5g}{152g/mol}$=0.0296mol,所以实验中水杨酸甲酯的产率为$\frac{0.0296mol}{0.05mol}$×100%=59%;
故答案为:59%.
点评 本题以物质的制备为背景,考查了常见仪器的构造与安装、混合物的分离、提纯、物质的制取、物质产率的计算等知识,题目难度较大,试题涉及的题量较大,知识点较多,充分培养了学生的分析、理解能力及灵活应用所学知识的能力.

| 二甲苯一溴代物的熔点/℃ | 234 | 206 | 213 | 204 | 214 | 205 |
| 对应的二甲苯的熔点/℃ | 13 | -54 | -27 | -54 | -27 | -54 |
| A. | 熔点为234℃的是一溴代间二甲苯 | B. | 熔点为234℃的是一溴代邻二甲苯 | ||
| C. | 熔点为-54℃的是间二甲苯 | D. | 熔点为-27℃的是对二甲苯 |
| A. | 热稳定性:HF>HCl>HBr>HI | B. | 微粒半径:K+>Na+>Mg2+ | ||
| C. | 酸性:HClO4>H2SO4>H3PO4 | D. | 还原性:Al>Mg>Na |
| A. | Na | B. | P | C. | S | D. | C |
| A. | 在标准状态下,1L庚烷完全燃烧后,所生成的气态产物的分子数为$\frac{7}{22.4}$NA | |
| B. | 1mol碳正离子CH5+所含的电子数为11NA | |
| C. | 标准状态下,16g甲烷完全燃烧所消耗的氧气的分子数为2NA | |
| D. | 0.5molC3H8分子中含C-H共价键2NA |

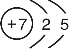 .
. Al(OH)3+3H+(用离子方程式表示).
Al(OH)3+3H+(用离子方程式表示).