题目内容
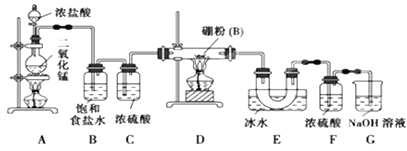
【题目】海水中溴元素以Br-形式存在,工业上用空气吹出法从海水中提取溴的工艺流程如图(见下页):
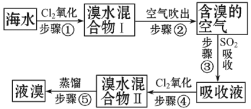
(1)步骤①反应的离子方程式是___。
(2)步骤③反应的化学方程式是___,从理论上考虑,下列也能吸收Br2的是___。
A.NaOH B.FeCl2 C.Na2SO3 D.H2O
(3)步骤⑤蒸馏的过程中,温度应控制在80℃~90℃。温度过高或过低都不利于生产,请解释原因:___。
【答案】2Br+Cl2═Br2+2Cl SO2+Br2+2H2O═H2SO4+2HBr ABC 若温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低
【解析】
海水中通入氯气氧化溴离子得到溴水的混合溶液,用热空气吹出溴单质得到含溴的空气,通过二氧化硫吸收后富集溴元素得到吸收液,再通入氯气氧化溴化氢得到溴水的混合溶液,蒸馏得到溴单质,
(1)海水中的溴离子容易被氯气氧化为溴的单质,氧化性氯气比溴强;
(2)溴单质有氧化性,二氧化硫具有还原性,溴和二氧化硫在水溶液中易发生氧化还原反应,溴单质和氢氧化钠溶液反应,和还原性的物质发生氧化还原反应;
(3)依据溴单质的沸点和水的沸点分析,溴的沸点是58.5°C,温度控制过高,水会沸腾,温度过低,溴蒸气不易挥发。
(1)海水中的溴离子容易被氯气氧化为溴的单质,氧化性氯气比溴强,反应的离子方程式为:2Br+Cl2═Br2+2Cl,故答案为:2Br+Cl2═Br2+2Cl;
(2)溴单质有氧化性,二氧化硫具有还原性,溴和二氧化硫在水溶液中易发生氧化还原反应,反应的化学方程式为SO2+Br2+2H2O═H2SO4+2HBr;下列物质也能吸收Br2的是,
A.NaOH溶液和溴单质反应生成溴化钠、次溴酸钠和水,可以吸收,故A正确;
B.FeCl2溶液具有还原性,可以被溴单质氧化为氯化铁,可以吸收溴单质,故B正确;
C.Na2SO3溶液具有还原性,可以被溴单质氧化,能吸收溴单质,故C正确;
D.H2O和溴单质反应微弱,不能充分吸收溴单质,故D错误;
故答案为:SO2+Br2+2H2O═H2SO4+2HBr,;ABC;
(3)溴的沸点是58.5℃,温度应控制在80~90℃最佳,温度控制过高,水会沸腾,溴蒸气中有水,温度过低,溴蒸气不易挥发,故答案为:若温度过高,大量水蒸气随溴排出,溴气中水蒸气的含量增加;温度过低,溴不能完全蒸出,产率太低。

 名校课堂系列答案
名校课堂系列答案【题目】(1)铁是人体必需的微量元素,目前市售补铁营养品较多,某研究性学习小组对补铁剂中铁的含量进行了测定。提供药品:FeCl2溶液(浅绿色)、FeCl3溶液(黄色)、铁粉、铜粉、KSCN溶液、氯水;仪器自选。
①将补铁剂中的Fe2+转化成Fe3+,结合你所选的试剂写出相关的离子方程式:______。
②若将Fe3+转化成Fe2+,结合你所选的试剂写出相关的离子方程式:__________。
(2)“服用维生素C,可使食物中的三价铁离子还原成二价铁离子”这句话指出维生素C在这一反应中做____剂,具有____性。
(3)某同学根据铁元素价态特点,提出这样一个观点:氯气与铁粉反应,当Cl2足量时生成FeCl3,当铁粉足量时产物是FeCl2,为验证该观点是否正确,该同学将一定质量铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
①提出假设:
假设1:该固体物质是FeCl2。
假设2:该固体物质是_______。
②设计实验方案:
取少量固体物质于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在A溶液中加KSCN溶液 | _______ | 固体物质中有FeCl3 |
在酸性高锰酸钾溶液中加少量A溶液 | 酸性高锰酸钾溶液颜色无明显变化 | _______ |
③根据上述实验结论,写出Cl2与铁粉加热时发生反应的化学方程式__________。