题目内容
【题目】甲、乙两组同学用不同的方法制备SO2并探究其性质。(夹持装置已略去)
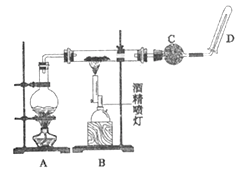
I.甲组同学设计的实验装置如图所示,回答下列问题:

(1)试管①中反应的化学方程式是__________。
(2)试管②中的品红溶液褪色。欲证明品红褪色的原因是SO2,需要补充的实验操作及应出现的实验现象是__________。
(3)试管③中的试剂是NaOH溶液,反应的离子方程式是___________。
II.乙组同学设计的实验装置如下图所示,回答下列问题:

已知: BaSO3是白色难溶于水的物质,但可溶解于盐酸。
(4)④中反应的化学方程式是__________。
(5)⑤中产生了不溶于盐酸的白色沉淀,该沉淀是___________。
(6)经过分析,乙组同学认为装置中的空气是出现白色沉淀的原因。他们在不改变实验装置的情况下加入了某操作过程,证实了这种猜测是正确的。他们的操作及实验现象是__________。
【答案】Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O 取下试管②并加热试管,试管内液体恢复红色 SO2+2OH-===SO32-+H2O Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O BaSO4 开始反应之前打开弹簧夹,向装置中鼓入一定量N2,夹紧弹簧夹。SO2气体产生后⑤中无白色沉淀
CuSO4+SO2↑+ 2H2O 取下试管②并加热试管,试管内液体恢复红色 SO2+2OH-===SO32-+H2O Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O BaSO4 开始反应之前打开弹簧夹,向装置中鼓入一定量N2,夹紧弹簧夹。SO2气体产生后⑤中无白色沉淀
【解析】
根据SO2实验室制备原理和的性质,解答有关实验问题,注意空气对实验的干扰。
I.(1)铜和浓硫酸反应的化学方程式是Cu + 2H2SO4(浓)![]() CuSO4+SO2↑+ 2H2O。
CuSO4+SO2↑+ 2H2O。
(2)SO2使品红褪色生成的无色物质是不稳定的,加热能重新生成品红而恢复红色。欲证明品红褪色是SO2引起的,需要取下试管②并加热,看到试管内液体恢复红色。
(3)试管③中NaOH溶液吸收尾气中的SO2,反应的离子方程式是SO2+2OH-===SO32-+H2O。
II.(4)Na2SO3和浓H2SO4反应的化学方程式是 Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O。
(5)因BaSO3可溶于盐酸,SO2与BaCl2溶液不反应,⑤中的白色沉淀不可能为BaSO3。从反应物的元素组成及物质性质看,空气中氧气参与了反应,生成了不溶于盐酸的BaSO4沉淀。
(6)为验证装置中的空气是出现白色沉淀的原因,需排出装置中的空气,再进行相同的其它实验操作,出现不同的实验现象。故先打开弹簧夹,向装置中鼓入一定量N2以排出空气。夹紧弹簧夹后,打开分液漏斗活塞加入浓硫酸,若⑤中无白色沉淀,即可证明。