题目内容
7.在恒容密闭容器中,充入2mol SO2和2mol O2,发生反应:2SO2(g)+O2(g)═2SO3(g)△H<0反应达到平衡后,下列措施能使正反应速率加快,且c(SO3)增大的是( )
| A. | 升高温度 | B. | 加入适当的催化剂 | ||
| C. | 充入He(g),使体系压强增大 | D. | 再向容器中通入2molO2 |
分析 A、升高温度,正反应速率增大,平衡向吸热方向;
B、加入适当的催化剂,正反应速率增大,平衡不移动;
C、充入He(g),使体系压强增大,但反应体系浓度没变,平衡不移动;
D、再向容器中通入2molO2,则增大反应物浓度,平衡正向移动.
解答 解:A、升高温度,正反应速率增大,但平衡向吸热方向即逆反应移动,则c(SO3)减小,故A错误;
B、加入适当的催化剂,正反应速率增大,但平衡不移动,则c(SO3)不变,故B错误;
C、充入He(g),使体系压强增大,但反应体系浓度没变,平衡不移动,则反应速率不变,故C错误;
D、再向容器中通入2molO2,则增大反应物浓度,平衡正向移动,所以正反应速率加快,且c(SO3)增大,故D正确;
故选:D.
点评 本题考查了化学平衡的影响因素分析判断,注意恒温恒容充入He(g),使体系压强增大,反应体系浓度没变,平衡不移动,题目难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.下列离子方程式中书写正确的是( )
| A. | Al2O3与NaOH溶液反应 Al2O3+2OH-═2 AlO2-+H2O | |
| B. | FeCl2溶液中通入Cl2 Fe2++Cl2═Fe3++2Cl- | |
| C. | FeCl3溶液与铜 Fe3++Cu═Fe2++Cu2+ | |
| D. | 用醋酸除水垢 2H++CaCO3═Ca2++H2O+CO2↑ |
18.下列电离方程式中不正确的是( )
| A. | H2SO4═2H++SO42- | B. | Ba(OH)2═Ba2++2OH- | ||
| C. | NaNO3═Na++NO3- | D. | KClO3═K++Cl-+3O2- |
2.在下列自然资源的开发利用中,不涉及化学变化的是( )
| A. | 通过石油分馏获得汽油 | B. | 以海带为原料制取碘单质 | ||
| C. | 利用海水制取金属镁 | D. | 用CO还原褐铁矿制备铁 |
12.微粒甲与离子乙在溶液中的转化关系如下所示:微粒甲$\stackrel{OH-}{→}$离子乙$\stackrel{H+}{→}$微粒甲,则微粒甲是( )
| A. | Al2O3 | B. | NH4+ | C. | Fe3+ | D. | CO2 |
19.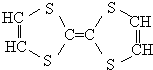 用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )
用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )
 用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )
用于制造隐形飞机的物质具有吸收微波的功能,其主要成分的结构如图,关于该分子的说法正确的有( )| A. | 分子中含有碳碳双键,属于烯烃 | |
| B. | 从碳骨架形状分析,应该属于环状烃 | |
| C. | 该分子属于高分子化合物 | |
| D. | 该分子中即有极性键,也有非极性键 |
16.下列不能形成配位键的是( )
| A. | Ag+ NH3 | B. | Cu2+ NH3 | C. | H+ H2O | D. | Ag+ CH4 |
17.下列事实中,不能用勒夏特列原理解释的是( )
| A. | 对熟石灰的悬浊液加热,悬浊液中固体质量增加 | |
| B. | 向稀盐酸中加入少量蒸馏水,盐酸中氢离子浓度降低 | |
| C. | 打开汽水瓶,有气泡从溶液中冒出 | |
| D. | 实验室中常用排饱和食盐水的方式收集氯气 |