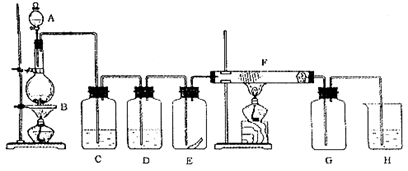
题目内容
(20分)已知某化工厂的含镍催化剂主要含有Ni,还含有Al (31%)、Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%)。某校化学研究性学习小组通过查阅资料,设计了如下图所示的方法以该含镍废催化剂为原料来制备NiSO4·7H2O。
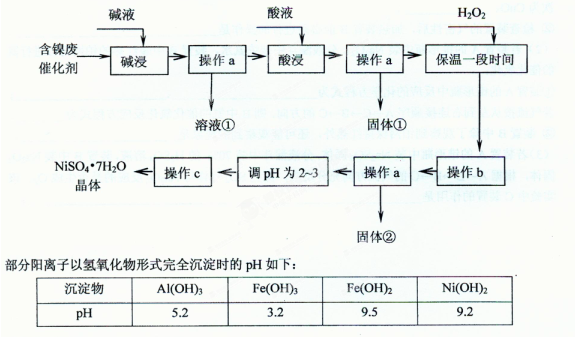
回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(2)“碱浸”的目的是除去 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(5)“调pH为2~3“的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
(7) NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式___ 。
(8)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 和可逆反应Fe2++ 2H2O 2H++ Fe(OH)2在25℃时的平衡常数
2H++ Fe(OH)2在25℃时的平衡常数

回答下列问题:
(1)操作a、c中需使用的仪器除铁架台(带铁圈)、酒精灯、烧杯、玻璃棒外还需要的主要仪器为 。
(2)“碱浸”的目的是除去 。
(3)“酸浸”时所加入的酸是 (填化学式)。酸浸后,经操作a分离出固体①后,溶液中可能含有的金属离子是 。
(4)操作b为调节溶液的pH,你认为pH的最佳调控范围是 。
(5)“调pH为2~3“的目的是 。
(6)产品晶体中有时会混有少量绿矾(FeSO4·7H2O),其原因可能是 。
(7) NiSO4在强碱溶液中用次氯酸钠氧化,可以制得碱性镍镉电池电极材料——NiOOH。该反应的离子方程式___ 。
(8)一般认为残留在溶液中的离子浓度小于1×10-5 mol/L时,沉淀已经完全。请利用上表中数据估算Fe(OH)2的溶度积 和可逆反应Fe2++ 2H2O
 2H++ Fe(OH)2在25℃时的平衡常数
2H++ Fe(OH)2在25℃时的平衡常数 
(1)操作a、操作c为过滤,所以还缺少主要仪器是漏斗
(2)含镍废催化剂中的AL、AL2O3能与碱液反应,其他成分不能与碱液反应。
(3)“酸浸”时所加入的酸是:稀硫酸,因为NiSO4·7H2O中含有硫酸根。
含镍废催化剂经碱液处理后,除去了AL、AL2O3,余下的成分主要为Ni,Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%),酸浸后,Ni,Fe(1.3%)的单质及氧化物能溶于硫酸,滤液中的金属离子是Ni2+、Fe2+离子;
(4)由于Fe2+离子氧化为Fe3+离子,所以调节溶液的pH最佳调控范围是3.2~9.2;
(5)Ni2+为弱碱阳离子,调pH为2~3的目的是抑制Ni2+的水解。
(6)可能是过氧化氢的量不足,导致e2+离子未被完全氧化造成的。
(7)由题信息得离子反应方程式为:2Ni2++CLO-+4OH-=2NiOOH+CL-+H2O;
(8)利用溶度积常数的计算方法处理计算。
(2)含镍废催化剂中的AL、AL2O3能与碱液反应,其他成分不能与碱液反应。
(3)“酸浸”时所加入的酸是:稀硫酸,因为NiSO4·7H2O中含有硫酸根。
含镍废催化剂经碱液处理后,除去了AL、AL2O3,余下的成分主要为Ni,Fe(1.3%)的单质及氧化物,其他不溶杂质(3.3%),酸浸后,Ni,Fe(1.3%)的单质及氧化物能溶于硫酸,滤液中的金属离子是Ni2+、Fe2+离子;
(4)由于Fe2+离子氧化为Fe3+离子,所以调节溶液的pH最佳调控范围是3.2~9.2;
(5)Ni2+为弱碱阳离子,调pH为2~3的目的是抑制Ni2+的水解。
(6)可能是过氧化氢的量不足,导致e2+离子未被完全氧化造成的。
(7)由题信息得离子反应方程式为:2Ni2++CLO-+4OH-=2NiOOH+CL-+H2O;
(8)利用溶度积常数的计算方法处理计算。

练习册系列答案
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案
相关题目
 8分,每空2分)
8分,每空2分)


 离子方程式为______________________________________________;
离子方程式为______________________________________________;
 物质的量为____________________。
物质的量为____________________。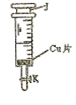
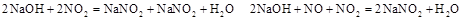
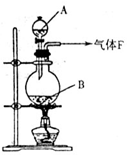
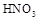 中,吸取适量的
中,吸取适量的 稀
稀 ,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。
,当注射器活塞上升到某一位置时,迅速打开阀门K,将反应液推入NaOH溶液中后关闭K。 学方程式并配以必要的文字说明)。
学方程式并配以必要的文字说明)。