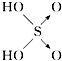题目内容
【题目】设NA表示阿伏伽德罗常数的值,下列说法错误的是( )
A.若1molL﹣1HF溶液中H+数目为NA , 则等体积的2molL﹣1HF溶液中H+数目为2NA
B.44gCO2、N2O组成的混合气体中所含有的原子数为3NA
C.36g3H2中含有的中子数目为24NA
D.2.24L(标准状况)O2与钠反应时,转移电子数目可能为0.3NA
【答案】A
【解析】解:A、HF为弱酸,浓度越大,则电离程度越小,故若1molL﹣1HF溶液中H+数目为NA , 则等体积的2molL﹣1HF溶液中H+数目小于2NA , 故A错误;B、CO2、N2O的摩尔质量均为44g/mol,故44g混合物的物质的量为1mol,且两者均为三原子分子,故1mol混合物中含3NA个原子,故B正确;
C、36g3H2的物质的量为n= ![]() =6mol,而1mol3H2中含4mol中子,故6mol3H2中含24NA个中子,故C正确;
=6mol,而1mol3H2中含4mol中子,故6mol3H2中含24NA个中子,故C正确;
D、标况下2.24L氧气的物质的量为0.1mol,而氧气反应后的价态可能为﹣1价,也可能为﹣2价,故0.1mol氧气当全部变为﹣1价时转移0.2NA个电子,当全部变为﹣2价时转移0.4NA个电子,由于产物中氧元素的价态不明确,故转移的电子介于0.2NA到0.4NA之间,即可能为0.3NA个,故D正确.
故选A.

 名校练考卷期末冲刺卷系列答案
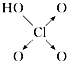
名校练考卷期末冲刺卷系列答案【题目】判断含氧酸强弱的一条经验规律是:含氧酸分子结构中含非羟基氧原子数越多,该含氧酸的酸性越强.含氧酸酸性强弱与非羟基氧原子数的关系如表所示:
含氧酸 | 次氯酸 | 磷酸 | 硫酸 | 高氯酸 |
结构式 | Cl﹣OH |
|
|
|
非羟基氧原子数 | 0 | 1 | 2 | 3 |
酸性 | 弱酸 | 中强酸 | 强酸 | 最强酸 |
已知:亚磷酸(H3PO3)和亚砷酸(H3AsO3)分子式相似,但它们的酸性差别很大,H3PO3是中强酸,H3AsO3既有弱酸性又有弱碱性.由此可推出:
①H3PO3的结构式为 , H3PO3与过量的NaOH溶液反应的化学方程式为;
②H3AsO3的结构式为 , 在H3AsO3中加入浓盐酸,反应的化学方程式为 .
【题目】X、Y、Z、W、N为前四周期五种元素,分别位于周期表中三个紧邻的周期,且原子序数逐渐增大,X、Y、Z的氢化物都比同族元素氢化物的沸点高.N原子外围未成对电子数是同周期中最多的.W元素的电离能数据见下表(kJmol﹣1):
I1 | I2 | I3 | I4 | … |
496 | 4562 | 6912 | 9540 | … |
请回答:
(1)W2Y2含有的电子式为 . 灼烧W2Y2时,火焰呈特殊颜色,请从原理上解释产生该现象的原因: .
(2)N元素基态原子的外围电子排布式是: .
(3)X3﹣的空间构型是 , 中心原子的杂化方式是 .
(4)用氢键表示式写出Z的氢化物水溶液中存在的氢键 .