题目内容
12.NH4Cl中存在的化学键有离子键和共价键;H2O比同主族的H2S、H2Se、H2Te的熔沸点反常地高,其原因是水分子间形成有氢键.分析 氯化铵中含铵根离子与氯离子之间的离子键,含N-H共价键;H2O中O吸电子能力强,易形成氢键,影响其熔沸点,以此来解答.
解答 解:NH4Cl中存在的化学键有离子键和共价键;H2O比同主族的H2S、H2Se、H2Te的熔沸点反常地高,其原因是水分子间形成有氢键,
故答案为:离子键;共价键;氢键.
点评 本题考查化学键,为高频考点,把握化学键的形成及判断的一般规律为解答的关键,侧重分析与应用能力的考查,注意氢键不是化学键,题目难度不大.

练习册系列答案
 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案
相关题目
13.Ⅰ.(1)在课本甲烷和氯气的取代反应实验中,向大试管中充入反应气体的方法是通过排饱和食盐水的方法先后收集半试管甲烷和半试管氯气.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
(1)x=27.00ml.
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
(2)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp=3.8×10 -9.CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合,若Na2CO3溶液的浓度为4×10 -4mo1/L,则生成沉淀所需CaCl2溶液的最小浓度为3.8×10-5mol/L.
Ⅱ.在温度t℃下,某Ba(OH)2的稀溶液中c(H+)=10-amol/L,c(OH-)=10-bmol/L,已知a+b=12,向该溶液中逐滴加入pH=b的NaHSO4,测得混合溶液的部分pH如下表所示:
| 序号 | 氢氧化钡溶液的体积/mL | 硫酸氢钠溶液的体积/mL | 溶液的pH |
| ① | 33.00 | 0.00 | 8 |
| ② | 33.00 | x | 7 |
| ③ | 33.00 | 33.00 | 6 |
(2)将此温度下的Ba(OH)2溶液取出1ml,加水稀释至1L,则此稀释后的溶液中c(Ba2+)﹕c(OH-)=1:20;
(3)与NaHSO4相同,NaHSO3 和NaHCO3也为酸式盐.已知NaHSO3溶液呈酸性、NaHCO3溶液呈碱性.现有浓度均为0.1mol•L-1的NaHSO3溶液和NaHCO3溶液,溶液中各粒子的物质的量浓度存在下列关系(R表示S或C),其中可能正确的是AC(填字母)
A.c(Na+)>c(HRO3-)>c(H+)>c(RO32-)>c(OH-)
B.c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-)
C.c(H+)+c(H2RO3)=c(RO32-)+c(OH-)
D.两溶液中c(Na+)、c(HRO3-)、c(RO32-)分别相等.
3.蛋白质发生下列过程中,可逆的是( )
| A. | 盐析 | B. | 变性 | C. | 煮熟 | D. | 加入酒精 |
20.以下4种有机物的分子式都是C4H10O:①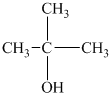 ②
②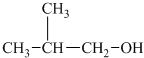 ③
③ ④CH3CH2CH2CH2OH,能被氧化成含相同碳原子数的醛的是( )
④CH3CH2CH2CH2OH,能被氧化成含相同碳原子数的醛的是( )
 ②
②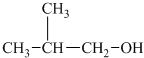 ③
③ ④CH3CH2CH2CH2OH,能被氧化成含相同碳原子数的醛的是( )
④CH3CH2CH2CH2OH,能被氧化成含相同碳原子数的醛的是( )| A. | ①② | B. | 只有② | C. | ①③ | D. | ②④ |
7.下列过程没有发生化学反应的是( )
| A. | 用活性炭去除冰箱中的异味 | |
| B. | 用浸泡过高锰酸钾溶液的硅藻土保存水果 | |
| C. | 用热碱水清除炊具上残留的油污 | |
| D. | 用含硅胶、铁粉的透气小袋与食品一起密封包装 |
4.下列表示物质结构的化学用语或模型正确的是( )
| A. | 中子数为8的碳原子:12C | B. | HF的电子式: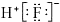 | ||
| C. | Cl-的结构示意图: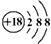 | D. | CH4分子的比例模型: |
1.下面是4位同学对“化学与健康”这一话题发表的见解中,正确的是( )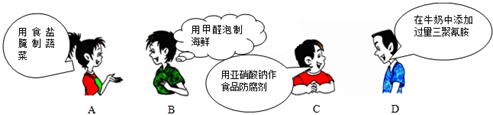

| A. | A | B. | B | C. | C | D. | D |
2.用NA表示阿伏伽德罗常数,下列说法错误的是( )
| A. | 1molFe和足量的足量的氯气完全反应,共失去3mol电子 | |
| B. | 含NA个氧原子的氧气在标准状况下的体积为11.2L | |
| C. | 1molNa原子中约含有11NA个电子 | |
| D. | 1个氢气分子的实际重量约为$\frac{1}{{N}_{A}}$g |