题目内容
已知Fe2+与K3[Fe(CN)6]溶液反应呈蓝色。某同学进行如下图的实验,将左铁棒的上、下两端各联上一锌片,而在右铁棒中段联上一铜片(如图1),并将它们同时静置于含有K3[Fe(CN)6]及酚酞的混合胶质溶液中。经一段时间后,发现图中的甲、乙、丙、丁、戊、己等六区均有变化(如图2)。下列关于各区变化情况的判断,正确的是( )
| A.甲区呈现蓝色 | B.乙区呈现红色 |
| C.戊区产生Cu2+离子 | D.丁区产生Fe3+离子 |
B
解析

研究人员最近发现了一种“水”电池,这种电池能利用淡水和海水之间含盐量的差别进行发电,在海水中电池总反应可表示为5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是
| A.Ag发生还原反应 |
| B.正极反应式:5MnO2+2e- =Mn5O102- |
| C.每生成1mol AgCl转移2mol电子 |
| D.Cl—不断 向“水”电池的正极移动 |
甲装置中所含的是物质的量之比为1:2的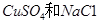 的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是
的混合溶液,电解过程中溶液的pH值随时间t变化的示意图如乙示(不考虑电解产物可能与水的反应)。试分析下列叙述中正确的是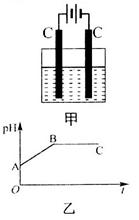
A.是该混合溶液中的 导致了A点溶液的pH值小于B点 导致了A点溶液的pH值小于B点 |
B.AB线段与BC线段在阴极上发生的反应是相同的即: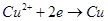 |
| C.BC段阴极产物和阳极产物的体积之比为2:1 |
| D.在整个电解的过程中会出现少量淡蓝色的Cu(OH)2沉淀 |
有关右图装置中的叙述正确的是 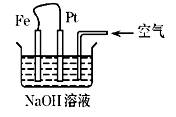
| A.这是电解NaOH溶液的装置 |
| B.这是一个原电池装置 |
| C.Pt为负极,其电极反应为:O2+2H2O+4e-= 4OH- |
| D.Fe为阳极,其电极反应为:Fe-2e-+2OH- = 2Fe(OH)2 |
有关下列装置的叙述不正确的是( )

| A.图①铝片发生的电极反应式是:Al+4OH--3e-=AlO2—+2H2O |
| B.图②发生析氢腐蚀,离子反应方程式为:Fe+2H+=Fe2++H2↑ |
| C.图③溶液中发生了变化:4Fe(OH)2+O2+2H2O=4Fe(OH)3 |
| D.图④充电时,阳极反应是:PbSO4+2H2O-2e-=PbO2+SO42—+4H+ |
CO无色无味有毒,世界各国每年均有不少人因CO中毒而失去生命。一种CO分析仪的工作原理如图所示,该装置中电解质为氧化钇-氧化钠,其中O2-可以在固体介质NASICON中自由移动。下列说法中错误的是 ( )。
| A.负极的电极反应式为CO+O2--2e-=CO2 |
| B.工作时电极b作正极,O2-由电极a向电极b移动 |
| C.工作时电子由电极a通过传感器流向电极b |
| D.传感器中通过的电流越大,尾气中CO的含量越高 |
下列有关电池的说法不正确的是 ( )。
| A.手机上用的锂离子电池属于二次电池 |
| B.铜锌原电池工作时,电子沿外电路从铜电极流向锌电极 |
| C.甲醇燃料电池可把化学能转化为电能 |
| D.锌锰干电池中,锌电极是负极 |
如图装置中,U形管内为红墨水,a、b试管中分别盛有食盐水和氯化铵溶液,各加入生铁块,放置一段时间。下列有关描述错误的是( )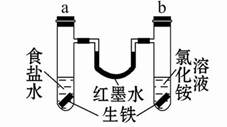
| A.a中发生了吸氧腐蚀,b中发生了析氢腐蚀 |
| B.两试管中负极反应均是:Fe-2e-=Fe2+ |
| C.生铁块中碳作原电池正极 |
| D.在一段时间后,红墨水两边液面变为左低右高 |
已知在pH为4~5的溶液中,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生拟用电解CuSO4溶液的方法测定铜的相对原子质量。该同学向pH=3.8酸化的、含有Fe2(SO4)3杂质的CuSO4溶液中加入过量的黑色粉末X,充分搅拌后将滤液用右图所示装置电解,其中某电极增重a g,另一电极上产生标准状况下的气体V mL。下列说法正确的是( )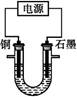
| A.铜电极连接电源正极 |
| B.黑色粉末X是铁粉 |
C.铜的相对原子质量的计算式是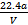 |
D.石墨电极上发生的反应是4OH--4e- O2↑+2H2O O2↑+2H2O |