题目内容
【题目】铬是常见的过渡金属之一,研究铬的性质具有重要意义。

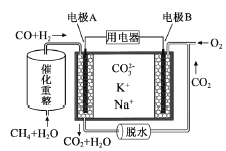
(1)在上图装置中,观察到装置甲铜电极上产生大量的无色气体;而装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体。由此可得到的结论_______________。
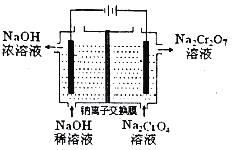
(2)工业上使用下图装置,采用石墨作电极电解Na2CrO4溶液,使Na2CrO4转化为Na2Cr2O7,其转化原理为_____。
(3)CrO3和K2Cr2O7均易溶于水,它们是工业废水造成铬污染的主要原因。要将Cr(VI)转化为Cr(III)常见的处理方法是电解法和铁氧磁体法。
①电解法:将含Cr2O72-的废水通入电解槽内,用铁作阳极,在酸性环境中,加入适量的NaC1进行电解,使阳极生成的Fe2+和Cr2O72-发生反应,其离子方程式为___________。阴极上Cr2O72-、H+、Fe3+都可能放电。若Cr2O72-放电,则阴极的电极反应式为_________;若H+放电,则阴极区形成Fe(OH)3和Cr(OH)3沉淀。
②铁氧磁体法:在含Cr(VI)的废水中加入绿矾,在pH<4时发生反应使Cr(VI)转化为Cr(III),调节溶液pH为6~8,使溶液中的Fe(I)、Fe(Ⅱ)、Cr(III)析出组成相当于Fe(Ⅱ)[Fe(III)x·Cr (III)2-x]O4(铁氧磁体 的沉淀,则铁氧磁体中x=_________。
【答案】由装置甲知铬的金属活动性比铜强;由装置乙知常温下铬在浓硝酸中钝化 阳极4OH--4e-=O2↑+2H2O,使c(H+)增大,从而导致2CrO42-+2H+=Cr2O72-+H2O反应发生 Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O Cr2O72-+6e-+14H+=2Cr3++7H2O 1.5
【解析】
(1)原电池中,负极上是失电子的氧化反应,装置甲铜电极上产生大量的无色气体,说明金属铜是正极;装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体二氧化氮产生,则金属铬是正极;
(2)电解池中阳极是溶液中氢氧根离子失电子生成氧气,溶液酸性增强,据此解答;
(3)①重铬酸根离子具有强的氧化性,可以将亚铁离子氧化,发生氧化还原反应;根据电荷和原子守恒书写阴极电极反应式;
②根据①的反应中铁离子与铬离子的物质的量之比列式计算铁氧磁体中x。
(1)原电池中,负极上是失电子的氧化反应,装置甲铜电极上产生大量的无色气体,说明金属铜是正极;装置乙中铜电极上无气体产生,铬电极上产生大量红棕色气体二氧化氮产生,是硝酸得到电子产生的二氧化氮,发生还原反应的电极是正极,则金属铬是正极,由此可得到的结论是:由装置甲知铬的金属活动性比铜强,由装置乙知常温下铬在浓硝酸中钝化;
(2)石墨电极电解Na2CrO4溶液,实现了Na2CrO4到Na2Cr2O7的转化,这是由于电解池中阳极是溶液中氢氧根离子失电子生成氧气:4OH--4e-=O2↑+2H2O,溶液酸性增强,使c(H+)增大,从而导致2CrO42-+2H+=Cr2O72-+H2O反应发生,所以实现了Na2CrO4到Na2Cr2O7的转化;
(3)①重铬酸根离子具有强的氧化性,可以将亚铁离子氧化,发生氧化还原反应,根据电子得失守恒、原子守恒和电荷守恒可知反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;在阴极上是溶液中的离子发生得电子的还原反应,若Cr2O72-放电,则阴极的电极反应式为Cr2O72-+6e-+14H+=2Cr3++7H2O;
②根据反应Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O可知Cr3+和Fe3+的物质的量之比为1:3,则:(2x)/x=1:3,解得x=1.5.

 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】化学反应速率和限度与生产、生活密切相关。
(1)某学生为了探究锌与盐酸反应过程中的速率变化,在400mL稀盐酸中加入足量的锌粉,用排水集气法收集反应放出的氢气(标准状况),实验记录如表(累计值):
时间(min) | 1 | 2 | 3 | 4 | 5 |
氢气体积(mL) | 100 | 240 | 464 | 576 | 620 |
①哪一时间段反应速率最大_______min(填0~1、1~2、2~3、3~4、4~5)。反应开始后反应速率先增大的原因是__________。
②求3~4分钟时间段以盐酸的浓度变化来表示的该反应速率_______(设溶液体积不变)。
(2)另一学生为控制反应速率防止反应过快难以测量氢气体积,他事先在盐酸中加入少量的下列溶液以减慢反应速率,你认为不可行的是(_______)
A.蒸馏水 B.KCl溶液 C.KNO3溶液 D.CuSO4溶液
(3)某温度下在4L密闭容器中,X、Y、Z三种气态物质的物质的量随时间变化曲线如图
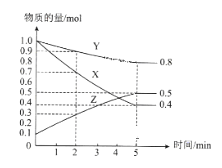
①该反应的化学方程式是____________。
②该反应达到平衡状态的标志是_________。
A.X、Y、Z的反应速率相等 B.X、Y的反应速率比为3:1
C.容器内气体压强保持不变 D.生成1mol Y的同时生成2mol Z
③2min内X的转化率为__________。
【题目】类推思维是化学解题中常用的一种思维方法,下列有关离子方程式的类推正确的是)
选项 | 已知 | 类推 |
A | 将Fe加入CuSO4溶液中:Fe+Cu2+=== Cu+Fe2+ | 将Na加入到CuSO4溶液中:2Na+Cu2+=== Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2:CO2+H2O+Ca2++2ClO-=== CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:SO2+H2O+Ca2++2ClO-=== CaSO3↓+2HClO |
C | 惰性电极电解氯化钠溶液:2Cl-+2H2O | 惰性电极电解MgBr2溶液:2Br-+2H2O |
D | 稀盐酸与NaOH溶液反应至中性:H++OH-===H2O | 稀硝酸与Ba(OH)2溶液反应至中性:H++OH-===H2O |
A. A B. B C. C D. D