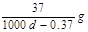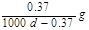题目内容
下列有关叙述正确的是
| A.高温下进行的反应都是吸热反应,常温下能够进行的反应都是放热反应 |
B.实验室用4mol SO2与2mol O2进行下列反应:2SO2(g)+O2(g)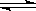 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% 2SO3(g)ΔH=-196.64kJ/mol,当放出314.624kJ热量时,SO2的转化率为80% |
| C.常温下,向纯水中通入一定量二氧化硫,则水的电离平衡被促进 |
| D.向3mL0.1mol/LAgNO3溶液中滴入5滴0.1mol/L NaCl溶液产生白色沉淀,再滴入KI稀溶液沉淀显黄色,则KSP(AgI)<KSP(AgCl) |
B
试题分析:A项:吸热反应、放热反应的依据与反应条件无关,只与反应前后总能量的大小有关,如果反应物的能量比生成物的能量高则放热,相反是吸热,故A错。C项:酸、碱都会抑制水的电离,二氧化硫通入到水中生成亚硫酸抑制水的电离,故C错。D项:由AgCl转化为AgI,说明KSP(AgI)>KSP(AgCl),故D错。故选B。
点评:知识点多且基础,主在考查学生对基础知识的掌握。影响水电离的因素1.温度。升温总是促进水的电离;2.酸,碱。强酸强碱(强电解质)总是抑制水的电离,弱酸弱碱(弱电解质)也抑制水的电离;3.能水解的盐,盐类(除酸式盐之外)总是促进水的电离;4.活泼金属。因为活泼金属总是与水店里出的氢离子反应,使氢离子浓度减小,所以总是促进水的电离。

练习册系列答案
相关题目
 Ca(OH)2(aq),
Ca(OH)2(aq),