题目内容
(1)298K、100kPa时,C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1 2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1 2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1,请写出298K时由C(s,石墨)和H2(g)生成1molC2H2(g)的热化学方程式______;(2)水是生命之源,也是化学反应中的主角.试回答下列问题:A.B.C是中学化学常见的三种有色物质(其组成的元素均属短周期元素),它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A.B.C与水反应的化学方程式:______;
(3)写出硫化钠在水溶液中水解的离子方程式______在配制硫化钠溶液时,为了防止发生水解,可以加入少量的______;
(4)明矾可做净水剂是因为______,有关的离子方程式为______;向明矾的水溶液中加入饱和的小苏打溶液,则观察到的现象是______,有关的离子方程式______;
(5)下列哪些事实能说明醋酸是弱酸______
①醋酸不易腐蚀衣服;
②0.1mol/L的CH3COONa溶液的PH约为9;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多;
④0.1mol/L的CH3COOH溶液PH约为2.9;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量.
【答案】分析:(1)利用盖斯定律求解;
(2)由短周期元素组成的有颜色的物质能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂常见的有NO2、Cl2和Na2O2;
(3)硫化钠水解呈碱性,以第一步水解为主,抑制硫化钠的水解可在溶液中加入碱;
(4)明矾的主要成分是KAl(SO4)2,Al3+水解产生胶状的Al(OH)3具有吸附性,Al3+离子与HCO3-离子发生相互促进的水解生成Al(OH)3和CO2气体;
(5)证明醋酸为弱电解质可从①醋酸钠溶液的酸碱性、②证明不完全电离、③存在电离平衡、④与强酸对比等角度或方法设计.
解答:解:(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1…①
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1…②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1…③
利用盖斯定律:2×①+ ×②-
×②- ×③可得:
×③可得:
2C(s,石墨)+H2(g)=C2H2(g)△H=2×(-393.5kJ?mol-1)+ ×(-571.6kJ?mol-1)-
×(-571.6kJ?mol-1)- ×(-2599kJ?mol-1)=226.7 kJ?mol-1;
×(-2599kJ?mol-1)=226.7 kJ?mol-1;
故答案为:2C(s,石墨)+H2(g)=C2H2(g)△H=226.7 kJ?mol-1;
(2)由短周期元素组成的有颜色的物质能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂常见的有NO2、Cl2和Na2O2,与水反应的化学方程式分别为:
3NO2+H2O=2HNO3+NO;Cl2+H2O=HCl+HClO; 2Na2O2+2H2O=4NaOH+O2↑,
故答案为:3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑;
(3)硫化钠水解呈碱性,以第一步水解为主,可只写第一步水解的离子方程式,抑制硫化钠的水解可在溶液中加入碱,如NaOH,
故答案为:S2-+H2O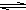 HS-+OH-;NaOH;
HS-+OH-;NaOH;
(4)明矾的主要成分是KAl(SO4)2,Al3+水解产生胶状的Al(OH)3具有吸附性,离子方程式为Al3++3H2O Al(OH)3+3H+,
Al(OH)3+3H+,
Al3+离子与HCO3-离子发生相互促进的水解生成Al(OH)3和CO2气体,反应的离子方程式为3HCO3-+Al3+=Al(OH)3↓+CO2↑,现象是有无色气体和白色絮状沉淀产生,
故答案为:Al3+水解产生的胶状的Al(OH)3具有吸附性,可以吸附水中的杂质;
Al3++3H2O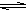 Al(OH)3+3H+;有无色气体和白色絮状沉淀产生 3HCO3-+Al3+=Al(OH)3↓+CO2↑;
Al(OH)3+3H+;有无色气体和白色絮状沉淀产生 3HCO3-+Al3+=Al(OH)3↓+CO2↑;
(5)①醋酸不易腐蚀衣服,与酸性的强弱无关;
②0.1mol/L的CH3COONa溶液的PH约为9,说明CH3COO-离子水解,证明醋酸为弱酸;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多,硫酸为二元酸,等物质的量时消耗NaOH多,不能证明醋酸为弱酸;
④0.1mol/L的CH3COOH溶液PH约为2.9,证明醋酸没有完全电离,为弱酸;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多,说明醋酸的浓度大,说明醋酸没有完全电离,为弱酸;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量,说明加入醋酸钠后溶液的氢离子浓度降低,生成弱电解质,证明醋酸为弱酸,
故答案为:②④⑤⑥.
点评:本题考查较为综合,具有一定难度,本题(1)注意盖斯定律的应用,(2)注意把握元素化合物知识的积累,(5)注意掌握证明弱电解质的实验方法.
(2)由短周期元素组成的有颜色的物质能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂常见的有NO2、Cl2和Na2O2;
(3)硫化钠水解呈碱性,以第一步水解为主,抑制硫化钠的水解可在溶液中加入碱;
(4)明矾的主要成分是KAl(SO4)2,Al3+水解产生胶状的Al(OH)3具有吸附性,Al3+离子与HCO3-离子发生相互促进的水解生成Al(OH)3和CO2气体;
(5)证明醋酸为弱电解质可从①醋酸钠溶液的酸碱性、②证明不完全电离、③存在电离平衡、④与强酸对比等角度或方法设计.
解答:解:(1)C(s,石墨)+O2(g)═CO2(g)△H1=-393.5kJ?mol-1…①
2H2(g)+O2(g)=2H2O(l)△H2=-571.6kJ?mol-1…②
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l)△H3=-2599kJ?mol-1…③
利用盖斯定律:2×①+
 ×②-
×②- ×③可得:
×③可得:2C(s,石墨)+H2(g)=C2H2(g)△H=2×(-393.5kJ?mol-1)+
 ×(-571.6kJ?mol-1)-
×(-571.6kJ?mol-1)- ×(-2599kJ?mol-1)=226.7 kJ?mol-1;
×(-2599kJ?mol-1)=226.7 kJ?mol-1;故答案为:2C(s,石墨)+H2(g)=C2H2(g)△H=226.7 kJ?mol-1;
(2)由短周期元素组成的有颜色的物质能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂常见的有NO2、Cl2和Na2O2,与水反应的化学方程式分别为:
3NO2+H2O=2HNO3+NO;Cl2+H2O=HCl+HClO; 2Na2O2+2H2O=4NaOH+O2↑,
故答案为:3NO2+H2O=2HNO3+NO、Cl2+H2O=HCl+HClO、2Na2O2+2H2O=4NaOH+O2↑;
(3)硫化钠水解呈碱性,以第一步水解为主,可只写第一步水解的离子方程式,抑制硫化钠的水解可在溶液中加入碱,如NaOH,
故答案为:S2-+H2O
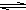 HS-+OH-;NaOH;
HS-+OH-;NaOH;(4)明矾的主要成分是KAl(SO4)2,Al3+水解产生胶状的Al(OH)3具有吸附性,离子方程式为Al3++3H2O
 Al(OH)3+3H+,
Al(OH)3+3H+,Al3+离子与HCO3-离子发生相互促进的水解生成Al(OH)3和CO2气体,反应的离子方程式为3HCO3-+Al3+=Al(OH)3↓+CO2↑,现象是有无色气体和白色絮状沉淀产生,
故答案为:Al3+水解产生的胶状的Al(OH)3具有吸附性,可以吸附水中的杂质;
Al3++3H2O
 Al(OH)3+3H+;有无色气体和白色絮状沉淀产生 3HCO3-+Al3+=Al(OH)3↓+CO2↑;
Al(OH)3+3H+;有无色气体和白色絮状沉淀产生 3HCO3-+Al3+=Al(OH)3↓+CO2↑;(5)①醋酸不易腐蚀衣服,与酸性的强弱无关;
②0.1mol/L的CH3COONa溶液的PH约为9,说明CH3COO-离子水解,证明醋酸为弱酸;
③进行中和滴定时,等体积等物质的量浓度的H2SO4溶液比等体积等物质的量浓度的CH3COOH溶液消耗的NaOH溶液多,硫酸为二元酸,等物质的量时消耗NaOH多,不能证明醋酸为弱酸;
④0.1mol/L的CH3COOH溶液PH约为2.9,证明醋酸没有完全电离,为弱酸;
⑤相同体积的PH均等于4的盐酸和CH3COOH溶液,被同一物质的量浓度的NaOH溶液中和,CH3COOH溶液消耗的NaOH溶液多,说明醋酸的浓度大,说明醋酸没有完全电离,为弱酸;
⑥镁粉与一定量稀硫酸反应,如果向其中加入少量醋酸钠可以降低反应速率但不改变产生气体的总量,说明加入醋酸钠后溶液的氢离子浓度降低,生成弱电解质,证明醋酸为弱酸,
故答案为:②④⑤⑥.
点评:本题考查较为综合,具有一定难度,本题(1)注意盖斯定律的应用,(2)注意把握元素化合物知识的积累,(5)注意掌握证明弱电解质的实验方法.

练习册系列答案
相关题目
 汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽车尾气(含烃类、CO、NO与SO2等)是城市主要污染源之一,治理的办法之一是在汽车排气管上装催化转化器,它使NO与CO反应生成可参与大气生态循环的无毒气体,反应原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
 Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.则此温度下该反应的平衡常数K=
Fe(SCN)2+来检验反应是否产生铁离子.已知在一定温度下该反应达到平衡时c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.则此温度下该反应的平衡常数K=
 2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题:
2NH3(g) ΔH<0 。反应中NH3的物质的量浓度的变化情况如下图所示,请回答下列问题: