题目内容
【题目】已知某“84消毒液”瓶体部分标签如图所示,该“84消毒液”通常稀释100倍(体积之比)后使用.请回答下列问题: 
(1)该“84消毒液”的物质的量浓度约为molL﹣1(小数点后保留一位).
(2)某同学取100mL该“84消毒液”,稀释后用于消毒,稀释后的溶液中c(Na+)=molL﹣1 .
(3)该同学参阅该“84消毒液”的配方,欲用NaClO固体配制480mL含NaClO质量分数为37.25%的消毒液.需要称量NaClO固体的质量为g
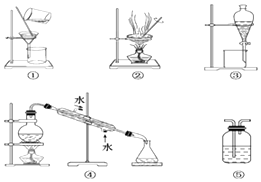
(4)配制上述“84消毒液”时,其正确的操作顺序是(每个操作只用一次): . A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.在烧杯中加入适量水溶解
C.将烧杯中的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀,装入贴有标签的试剂瓶
E.改用胶头滴管加水,使溶液的凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度1~2cm处
G.用天平称量该物质
(5)在溶液配制过程中,下列操作使溶液浓度偏小的是: .
A.定容时仰视容量瓶刻度线
B.容量瓶在使用前未干燥,里面有少量蒸馏水
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线.
E.转移溶液时未洗涤烧杯.
【答案】
(1)6.0
(2)0.06
(3)223.5
(4)G→B→C→A→F→E→D
(5)ADE
【解析】解:(1)密度1.2g/mL,质量分数为:37.25%的次氯酸钠溶液物质的量浓度C= ![]() =6.0mol/L;所以答案是:6.0;(2)设稀释后次氯酸钠物质的量浓度C′,则依据溶液稀释过程中溶质的物质的量不变得:6.0mol/L×100mL=10000mL×C′,解得C′=0.06mol/L,次氯酸钠为强电解质,钠离子物质的量浓度等于次氯酸钠物质的量浓度为:0.06mol/L;所以答案是:0.06;(3)欲用NaClO固体配制480mL含NaClO质量分数为37.25%的消毒液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量为:0.5L×6.0mol/L×74.5g/mol=223.5g;所以答案是:223.5;(4)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的操作顺序为:G→B→C→A→F→E→D;所以答案是:G→B→C→A→F→E→D;(5)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故A选; B.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
=6.0mol/L;所以答案是:6.0;(2)设稀释后次氯酸钠物质的量浓度C′,则依据溶液稀释过程中溶质的物质的量不变得:6.0mol/L×100mL=10000mL×C′,解得C′=0.06mol/L,次氯酸钠为强电解质,钠离子物质的量浓度等于次氯酸钠物质的量浓度为:0.06mol/L;所以答案是:0.06;(3)欲用NaClO固体配制480mL含NaClO质量分数为37.25%的消毒液,应选择500mL容量瓶,实际配制500mL溶液,需要溶质的质量为:0.5L×6.0mol/L×74.5g/mol=223.5g;所以答案是:223.5;(4)配制一定物质的量浓度溶液一般步骤为:计算、称量、溶解、冷却、移液、洗涤、定容、摇匀、装瓶,所以正确的操作顺序为:G→B→C→A→F→E→D;所以答案是:G→B→C→A→F→E→D;(5)A.定容时仰视容量瓶刻度线,导致溶液体积偏大,溶液浓度偏低,故A选; B.容量瓶在使用前未干燥,里面有少量蒸馏水,对溶质的物质的量和溶液体积都不产生影响,溶液浓度不变,故B不选;
C.容量瓶在使用前刚刚配制完一定物质的量浓度的“84消毒液”而未洗净,导致溶质的物质的量偏大,溶液浓度偏高,故C不选;
D.定容摇匀后发现液面低于容量瓶的刻度线,再用胶头滴管加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D选;
E.转移溶液时未洗涤烧杯,导致溶质的物质的量偏小,溶液浓度偏低,故E选;
故选:ADE.

 轻松暑假总复习系列答案
轻松暑假总复习系列答案