题目内容
X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,Z原子外围电子排布式为nsnnp2n,W原子核外的M层中只有两对成对电子,Q的核电荷数是Z与W的核电荷数之和.请回答下列问题:
(1)X、W的元素符号依次为______、______;
(2)写出Y2的电子式______;
(3)WZ2与XZ2分子的空间结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式);
(4)Q在元素周期表______区(填s、p、d、ds、f),其外围电子排布式为______,在形成化合物时它的最高化合价为______.
(1)X、W的元素符号依次为______、______;
(2)写出Y2的电子式______;
(3)WZ2与XZ2分子的空间结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式);
(4)Q在元素周期表______区(填s、p、d、ds、f),其外围电子排布式为______,在形成化合物时它的最高化合价为______.
X、Y、Z、W、Q五种元素原子序数依次增大,X原子核外的L层电子数是K层的两倍,故L层有4个电子,故X为C元素;Z原子外围电子排布式为nsnnp2n,s能级最多容纳2个电子,故Z原子外围电子排布式为2s22p4,故Z为O元素;Y的原子序数介于C、O元素之间,故Y为N元素;W原子核外的M层中只有两对成对电子,则外围电子排布式为3s23p4,故W为S元素;Q的核电荷数是Z与W的核电荷数之和,故Q的核电荷数为8+16=24,为Cr元素.
(1)由上述分析可知,X为C元素,W为S元素.
故答案为:C;S.
(2)Y为N元素,氮气分子中N原子之间形成3对共用电子对,电子式为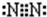 .
.
故答案为: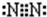 .
.
(3)WZ2为SO2,杂化轨道数为
=3,采取sp2杂化,含有1对孤对电子,故空间结构为V形;XZ2为CO2,杂化轨道数为
=2,采取sp杂化,没有对孤对电子,故空间结构为直线型;SO2是极性分子,CO2是非极性分子,水是极性分子,根据形似相溶原理,SO2在水中的溶解度较大.
故答案为:V形;直线型;SO2.
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d54s1,在形成化合物时它的最高化合价为+6价.
故答案为:d;3d54s1;+6.
(1)由上述分析可知,X为C元素,W为S元素.
故答案为:C;S.
(2)Y为N元素,氮气分子中N原子之间形成3对共用电子对,电子式为
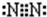 .
.故答案为:
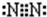 .
.(3)WZ2为SO2,杂化轨道数为
| 6 |
| 2 |
| 4 |
| 2 |
故答案为:V形;直线型;SO2.
(4)Q的核电荷数为24,是Cr元素,处于周期表第四周期第ⅥB族,在元素周期表d区,其外围电子排布式为 3d54s1,在形成化合物时它的最高化合价为+6价.
故答案为:d;3d54s1;+6.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (4)E能与AB形成配合物,其中E提供______,AB提供______.
(4)E能与AB形成配合物,其中E提供______,AB提供______.