题目内容
 (2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).
(2011?崇明县一模)在500mL 某浓度的硝酸溶液中加入20g铁粉,充分反应后,将反应液过滤、洗涤、干燥,称得固体质量为3.2g,产生的NO2和NO气体经测定为8.96L(标准状况).(1)混合气体中NO2和NO体积比为
3:1
3:1
;(2)所用HNO3的物质的量浓度为
2
2
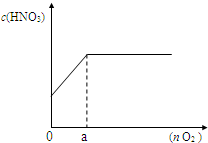
mol/L;(3)如图,若将上述反应产生的混合气体加入n mol氧气一起通入水中,配成100mL溶液,所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系.
①a 点的数值是
0.15
0.15
mol;②当n=0.12mol时,所得硝酸溶液的物质的量浓度
3.6mol/L
3.6mol/L
;③通过计算,求出所得硝酸溶液的物质的量浓度(c)与加入氧气的物质的量(n)的关系式
n≥0.15mol、c(HNO3)=4mol/L
n≥0.15mol、c(HNO3)=4mol/L
,0<n≤0.15mol、c(HNO3)=(2+
)mol/L
| 40n |
| 3 |
0<n≤0.15mol、c(HNO3)=(2+
)mol/L
.(写出计算过程)| 40n |
| 3 |
分析:(1)根据n=
计算参加反应的Fe的物质的量,根据n=
计算混合气体的物质的量,铁剩余,硝酸完全反应,反应生成硝酸亚铁,令NO2和NO的物质的量分别为xmol、ymol,根据电子转移守恒与二者物质的量之和列方程,据此计算解答;
(2)根据N元素守恒可知n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2),据此计算;
(3)①a点NO2和NO气体完全反应,根据电子注意守恒,氧气获得的电子等于参加反应的铁提供的电子,据此计算氧气的物质的量;
②根据①中a的值,判断发生的反应,若0.12≥a,则根据N元素守恒计算,生成的硝酸;
若0.12<a,根据混合气体中NO2和NO气体比例关系,写出混合气体与氧气反应的总反应方程式,还发生二氧化氮与水反应,根据氧气计算生成的硝酸、剩余的NO2和NO混合气体的物质的量,再计算二氧化氮与水反应生成的硝酸的物质的量,再根据c=
计算硝酸浓度;
③根据混合气体中NO2和NO气体比例关系,写出混合气体与氧气反应的总反应方程式,据此讨论:
A、当n(O2)≥0.15mol时,NO2和NO完全反应,根据N元素计算生成硝酸物质的量,再根据c=
计算硝酸浓度;
B、当0<n(O2)≤0.15mol时,氧气不足量,还发生二氧化氮与水反应,根据氧气计算生成的硝酸、剩余的NO2和NO混合气体的物质的量,再计算二氧化氮与水反应生成的硝酸的物质的量,再根据c=
计算硝酸浓度.
| m |
| M |
| V |
| Vm |
(2)根据N元素守恒可知n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2),据此计算;
(3)①a点NO2和NO气体完全反应,根据电子注意守恒,氧气获得的电子等于参加反应的铁提供的电子,据此计算氧气的物质的量;
②根据①中a的值,判断发生的反应,若0.12≥a,则根据N元素守恒计算,生成的硝酸;
若0.12<a,根据混合气体中NO2和NO气体比例关系,写出混合气体与氧气反应的总反应方程式,还发生二氧化氮与水反应,根据氧气计算生成的硝酸、剩余的NO2和NO混合气体的物质的量,再计算二氧化氮与水反应生成的硝酸的物质的量,再根据c=
| n |
| V |
③根据混合气体中NO2和NO气体比例关系,写出混合气体与氧气反应的总反应方程式,据此讨论:
A、当n(O2)≥0.15mol时,NO2和NO完全反应,根据N元素计算生成硝酸物质的量,再根据c=
| n |
| V |
B、当0<n(O2)≤0.15mol时,氧气不足量,还发生二氧化氮与水反应,根据氧气计算生成的硝酸、剩余的NO2和NO混合气体的物质的量,再计算二氧化氮与水反应生成的硝酸的物质的量,再根据c=
| n |
| V |
解答:解:(1)因为铁粉有剩余,所以溶液中存在的一定是Fe(NO3)2,参加反应的n(Fe)=
=0.3mol,
n(NO+NO2)=
=0.4mol,
令NO2和NO的物质的量分别为xmol、ymol,则:
,解得x=0.3,y=0.1,
故混合气体中NO2和NO体积比为0.3mol:0.1mol=3:1
故答案为:3:1;
(2)因为铁粉有剩余,所以溶液中存在的一定是Fe(NO3)2,由(1)中参加反应的n(Fe)=0.3mol,则n[Fe(NO3)2]=0.3mol,n(NO+NO2)=0.4mol,根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2)=0.3mol×2+0.4mol=1mol,
故:c(HNO3)=
=2mol/L,
故答案为:2;
(3)①由图可知,a点NO2和NO气体完全反应,根据电子注意守恒,氧气获得的电子等于参加反应的铁提供的电子,由(1)中可知参加反应的n(Fe)=0.3mol,反应生成Fe(NO3)2,故a点氧气的物质的量为
=0.15mol,
故答案为:0.15;
②由(1)可知混合气体中NO2和NO体积比为3:1,故与氧气一起通入水中,总反应式为6NO2+2NO+3O2+4H2O=8HNO3,
由于0.12<a,故氧气不足,由总反应方程式可知,氧气完全反应生成硝酸为0.12mol×
=0.32mol,消耗NO2为0.12mol×
=0.24mol,故剩余NO2为0.3mol-0.24mol=0.06mol,故发生反应3NO2+H2O=2HNO3+NO,又生成硝酸为0.06mol×
=0.04mol,故共生成硝酸0.32mol+0.04mol=0.36mol,所得硝酸的浓度为:
=3.6mol/L,
故答案为:3.6mol/L;
③A、当n(O2)≥0.15mol时,氧气足量,NO2和NO完全反应,N元素可知生成硝酸物质的量n(HNO3)=+n(NO+NO2)=0.4mol,故c(HNO3)=
=4mol/L,
B、当0<n(O2)≤0.15mol时,氧气不足量,由6NO2+2NO+3O2+4H2O=8HNO3可知,氧气完全反应生成硝酸为nmol×
=
mol,消耗NO2为nmol×
=2nmol,故剩余NO2为0.3mol-2n mol=(0.3-2n)mol,故发生反应3NO2+H2O=2HNO3+NO,又生成硝酸为(0.3-2n)mol×
=(0.2-
)mol,故共生成硝酸
mol+(0.2-
)mol=(0.2+
)mol,故c(HNO3)=
=(2+
)mol/L,
故答案为:n≥0.15mol、c(HNO3)=4mol/L;0<n≤0.15mol、c(HNO3)=(2+
)mol/L.
| 20g-3.2g |
| 56g/mol |
n(NO+NO2)=
| 8.96L |
| 22.4L/mol |
令NO2和NO的物质的量分别为xmol、ymol,则:
|
故混合气体中NO2和NO体积比为0.3mol:0.1mol=3:1
故答案为:3:1;
(2)因为铁粉有剩余,所以溶液中存在的一定是Fe(NO3)2,由(1)中参加反应的n(Fe)=0.3mol,则n[Fe(NO3)2]=0.3mol,n(NO+NO2)=0.4mol,根据N元素守恒:n(HNO3)=2n[Fe(NO3)2]+n(NO+NO2)=0.3mol×2+0.4mol=1mol,
故:c(HNO3)=
| 1mol |
| 0.5L |
故答案为:2;
(3)①由图可知,a点NO2和NO气体完全反应,根据电子注意守恒,氧气获得的电子等于参加反应的铁提供的电子,由(1)中可知参加反应的n(Fe)=0.3mol,反应生成Fe(NO3)2,故a点氧气的物质的量为
| 0.3mol×2 |
| 4 |
故答案为:0.15;
②由(1)可知混合气体中NO2和NO体积比为3:1,故与氧气一起通入水中,总反应式为6NO2+2NO+3O2+4H2O=8HNO3,
由于0.12<a,故氧气不足,由总反应方程式可知,氧气完全反应生成硝酸为0.12mol×
| 8 |
| 3 |
| 6 |
| 3 |
| 2 |
| 3 |
| 0.36mol |
| 0.1L |
故答案为:3.6mol/L;
③A、当n(O2)≥0.15mol时,氧气足量,NO2和NO完全反应,N元素可知生成硝酸物质的量n(HNO3)=+n(NO+NO2)=0.4mol,故c(HNO3)=
| 0.4mol |
| 0.1L |
B、当0<n(O2)≤0.15mol时,氧气不足量,由6NO2+2NO+3O2+4H2O=8HNO3可知,氧气完全反应生成硝酸为nmol×
| 8 |
| 3 |
| 8n |
| 3 |
| 6 |
| 3 |
| 2 |
| 3 |
| 4n |
| 3 |
| 8n |
| 3 |
| 4n |
| 3 |
| 4n |
| 3 |
(0.2+
| ||
| 0.1L |
| 40n |
| 3 |
故答案为:n≥0.15mol、c(HNO3)=4mol/L;0<n≤0.15mol、c(HNO3)=(2+
| 40n |
| 3 |
点评:本题考查混合物的计算、根据方程式的计算等,题目计算量较大,过程复杂,为易错题目,难度较大,注意利用守恒思想进行的计算,(3)中关键是利用总反应式进行讨论,简化计算.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
 (2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )
(2011?崇明县一模)如图,下列各组中,一定量的气体X和一定量的气体Y同时通入盛有溶液Z的洗气瓶中,最终肯定有沉淀生成的是(假定实验过程中不发生倒吸现象)…( )