题目内容
【题目】现有一定量含有Na2O杂质的Na2O2试样,用下图所示的实验装置测定Na2O2试样的纯度。(可供选用的试剂只有CaCO3固体、6 mol·L-1盐酸、6 mol·L-1硫酸和蒸馏水)
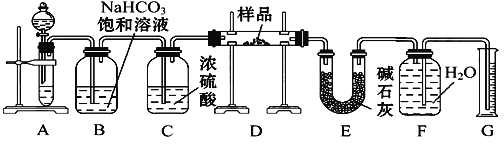
回答下列问题:
(1)装置A中液体试剂选用____ ;实验开始前盛装此药品的仪器名称是_____ ;B中饱和NaHCO3 溶液能否改为饱和Na2CO3 溶液 ______
(2)装置B的作用是________;装置C的作用是________;装置E中碱石灰的作用是___________。
(3)装置D中发生的主要反应的化学方程式是_________ 最后在F中收集到的气体是 _____
(4)若删去E装置,又会是什么后果:______(填偏高、偏低或无影响),
(5)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为____。
【答案】 6 mol·L-1盐酸 分液漏斗 不能 除去气体中的HCl 干燥CO2 吸收装置D中反应剩余的CO2 2Na2O2+2CO2==2Na2CO3+O2 ,Na2O+CO2 ==Na2CO3 O2 高 78%
【解析】试题分析:(1)装置A是碳酸钙和酸反应生成二氧化碳;B装置的作用是除去二氧化碳中的氯化氢,二氧化碳与碳酸钠溶液反应生成碳酸氢钠;(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,浓硫酸具有吸水性,可以干燥二氧化碳气体,装置E中碱石灰的作用是吸收二氧化碳,防止对氧气的体积测量造成干扰;(3)氧化钠和过氧化钠都能和二氧化碳反应,反应后的气体有氧气和二氧化碳,二氧化碳被装置E中的碱石灰吸收;(4)若删去装置E,F中收集到的氧气体积偏大;(5)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02ml。
解析:(1)装置A是碳酸钙和酸反应生成二氧化碳,碳酸钙和硫酸反应时,生成的硫酸钙是微溶于水的,会覆盖在碳酸钙的表面,使反应不能持续,所以用盐酸而不用硫酸;根据装置图,实验开始前盛装盐酸的仪器是分液漏斗;B装置中碳酸氢钠的作用是除去二氧化碳中的氯化氢,二氧化碳能与碳酸钠反应,所以不能把B中饱和NaHCO3 溶液能否改为饱和Na2CO3 溶液;(2)碳酸钙和盐酸反应生成的二氧化碳气体中含有氯化氢气体,可以用饱和碳酸氢钠来除去,所以B的作用是除去二氧化碳气体中的HCl,浓硫酸具有吸水性,可以将二氧化碳干燥,所以装置C的作用是干燥CO2,装置E中碱石灰的作用是吸收装置D中反应剩余的CO2,防止对氧气的体积测量造成干扰;(3)氧化钠和过氧化钠都能和二氧化碳反应,反应方程式分别为2Na2O2+2CO2=2Na2CO3+O2、Na2O+CO2=Na2CO3;反应后的气体有氧气和二氧化碳,二氧化碳被装置E中的碱石灰吸收,所以装置F中收集到的气体是氧气;(4)若删去装置E,F中收集到的氧气体积偏大,计算出的Na2O2的质量偏大,试样的纯度偏高;(5)根据反应2Na2O2+2CO2=2Na2CO3+O2,反应结束后测得气体体积为224mL(标准状况),即生成的氧气的量0.01mol,过氧化钠的物质的量为0.02ml,过氧化钠的纯度=![]() =78%。
=78%。






