题目内容
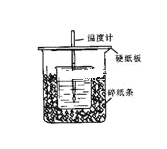
【题目】1,2-二溴乙烷可作汽油抗爆剂的添加剂,常温下它是无色液体,密度是2.18g/cm3沸点131.4℃,熔点9.79℃,不溶于水,易溶于醇、醚、丙酮等有机溶剂。在实验中可以用下图所示装置制备1,2-二溴乙烷。其中分液漏斗和烧瓶a中装有乙醇和浓硫酸的混合液,试管d中装有液溴(表面覆盖少量水)。
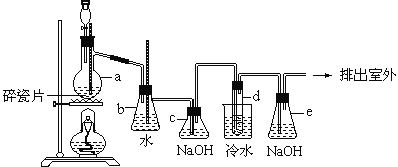
填写下列空白:
(1)装置a中烧瓶内发生反应的化学方程式为______________________。
(2)安全瓶b可以防止倒吸,并可以检查实验进行时试管d是否发生堵塞,请写出发生堵塞时瓶b中的现象________________________________________。
(3)容器c中NaOH溶液的作用是___________________________________。
(4)开始反应时需向装置d中的烧杯里加入冰水,是为了防止液溴挥发,烧杯中试管内发生的反应的化学方程式是____________________________。
【答案】![]() (条件错不得分) b中水面会下降,玻璃管中的水面会上升,甚至溢出 除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫
(条件错不得分) b中水面会下降,玻璃管中的水面会上升,甚至溢出 除去乙烯中带出的酸性气体或答二氧化碳、二氧化硫 ![]()
【解析】
实验原理:乙醇和浓硫酸反应主要生成乙烯气体,还可能混有碳和浓硫酸反应生成的CO2和SO2气体,b为安全瓶,c为净化除杂装置,d为乙烯和溴的反应装置,e为尾气吸收装置。
(1)烧瓶a中乙醇发生消去反应制取制取乙烯,发生反应的化学方程式为![]() ;
;
(2)试管d发生堵塞时,b中压强不断增大,导致b中水面下降,玻璃管中的水柱上升,甚至溢出;
(3)a中浓硫酸可以使部分乙醇脱水,生成碳,碳和浓硫酸反应生成H2O、CO2和SO2气体,混合气体通过c瓶,CO2和SO2气体被氢氧化钠吸收;
(4)装置d中试管内的液溴和乙烯发生加成反应,发生的反应的化学方程式是![]() 。
。

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
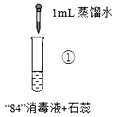
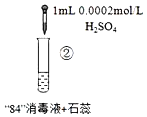
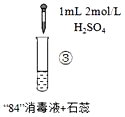
开心蛙口算题卡系列答案【题目】“84”消毒液(工业利用Cl2与NaOH反应制得)可用于消毒和漂白,下列实验现象的分析不正确的是
实验操作 |
|
|
|
实验现象 | 混合后溶液的pH=9.9,短时间内未褪色,一段时间后蓝色褪去。 | 混合后溶液pH=5.0,蓝色迅速褪去,无气体产生。 | 混合后溶液pH=3.2,蓝色迅速褪去,并产生大量气体,使湿润的淀粉碘化钾试纸变蓝。 |
A.对比实验①和②,②中蓝色迅速褪去的原因是发生了反应ClO+H+═HClO
B.实验③中产生的气体是Cl2,由HClO分解得到:2HClO═Cl2↑+H2O
C.对比实验②和③,溶液的pH可能会影响ClO的氧化性或Cl的还原性
D.加酸可以提高“84”消毒液的漂白效果,但需要调控合适的pH才能安全使用