题目内容
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
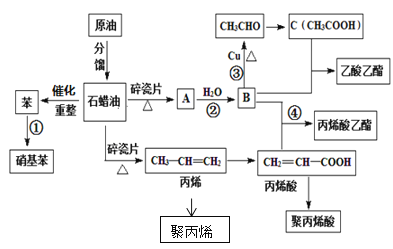
(1)A的结构简式为__,丙烯酸中官能团的名称为___。
(2)写出下列反应的反应类型①__,③___。
(3)用一种方法鉴别B和C,所用试剂是__。
(4)写出下列反应方程式:
丙烯→聚丙烯__;
丙烯酸+B→丙烯酸乙酯__。
【答案】CH2=CH2 碳碳双键、羧基 硝化反应或取代反应 氧化反应 Na2CO3或NaHCO3溶液或紫色石蕊试液 nCH2=CHCH3![]()
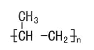 CH2=CHCOOH+CH3CH2OH
CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O
CH2=CHCOOCH2CH3+H2O
【解析】
B氧化生成C,且二者反应生成乙酸乙酯,则B为乙醇,C为乙酸,而A与水反应得到乙醇,则A为乙烯;乙醇与丙烯酸发生酯化反应生成丙烯酸乙酯;丙烯酸发生加聚反应得到聚丙烯酸;苯与浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成硝基苯,据此分析。
(1)A为乙烯,含有碳碳双键,结构简式为:CH2=CH2;丙烯酸中官能团的名称为羧基和碳碳双键;
(2) 反应①是苯发生硝化反应生成硝基苯,属于取代反应;反应③是乙醇发生氧化反应生成乙醛;
(3) B是乙醇,官能团是羟基,C是乙酸,官能团是羧基,鉴别乙醇和乙酸可以利用乙酸的性质来鉴别,遇Na2CO3或NaHCO3溶液出现气体的是乙酸,使紫色石蕊试液变红的液体是乙酸;
(4) 丙烯发生加聚反应得到聚丙烯:化学反应方程式为:nCH2=CHCH3![]()
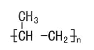 ;
;
丙烯酸和乙醇发生酯化反应得到丙烯酸乙酯和水,反应过程为酸脱去羟基,醇脱去氢原子,化学反应方程式为:CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O。
CH2=CHCOOCH2CH3+H2O。

练习册系列答案
相关题目