题目内容
如图中的纵坐标表示沉淀的物质的量,横坐标表示加入x的物质的量,请将各图一一对应的反应的代号填入每图下方的括号内.
A.AlCl3溶液中滴入NaOH溶液 B.NaAlO2溶液中通入HCl
C.稀硫酸中滴入Ba(OH)2溶液 D.石灰水中通入CO2
E.AlCl3溶液中滴入氨水 F.AlCl3溶液中滴入NaAlO2溶液
G.在盐酸酸化的AlCl3溶液中,滴入KOH溶液 H.AlCl3、MgSO4的混合溶液中加入过量NaOH溶液.
解:A、氯化铝溶液中加入氢氧化钠溶液先发生Al3++3OH-═Al(OH)3↓生成沉淀,后发生Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,前后消耗氢氧化钠的体积之比为3:1,故图象(2)符合;
B、NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,发生反应,Al(OH)3+3HCl=AlCl3+3H2O,氢氧化铝溶解,前后两部分消耗的盐酸体积为1:3,故图象(1)符合;
C、硫酸中滴入Ba(OH)2的溶液发生氢氧化钡与硫酸的生成硫酸钡沉淀,最后沉淀达最大后不溶解,沉淀最大值与氢氢氧化钡的物质的量之比为1:1,故图象(4)符合;
D、石灰水中通入二氧化碳,先发生Ca(OH)2+CO2═CaCO3↓+H2O,生成沉淀,后发生CO2+CaCO3+H2O═Ca(HCO3)2,沉淀消失,前后两部分二氧化碳的物质的量为1:1,沉淀最大值与二氧化碳的物质的量之比为1:1,故图象(3)符合;
E、氯化铝中加入氨水生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,发生的反应为Al3++3OH-═Al(OH)3↓,沉淀最大值与一水合氨的物质的量之比为1:3,故图象(5)符合;
F、AlCl3溶液中滴入NaAlO2溶液,发生双水解反应生成氢氧化铝沉淀,最后沉淀达最大后不溶解,发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,沉淀最大值与偏铝酸钠的物质的量之比为4:3,故图象(6)符合;
G、盐酸酸化的AlCl3溶液中滴入KOH溶液,先发生盐酸与氢氧化钠反应,不产生沉淀,然后发生氯化铝与氢氧化钠反Al3++3OH-═Al(OH)3↓成氢氧化铝沉淀,沉淀达最大后,发生氢氧化铝与氢氧化钠反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,沉淀生成与溶解前后两部分两部分消耗的氢氧化钠的物质的量3:1,故图象(8)符合;
H、AlCl3、MgSO4混合溶液中滴加NaOH溶液发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,沉淀量减少但不会完全溶解,故图象(7)符合.
故答案为:(1)B; (2)A;(3)D; (4)C; (5)E;(6)F;(7)H;(8)G.
分析:A、氯化铝溶液中加入氢氧化钠溶液先生成沉淀,后沉淀溶解至最后消失,根据方程式判断前后两部分两部分消耗的氢氧化钠物质的量关系,判断沉淀最大值与氢氧化钠的物质的量关系;
B、NaAlO2溶液中加入稀盐酸,先生成氢氧化铝沉淀,后沉淀溶解,根据方程式判断前后两部分两部分消耗的盐酸物质的量关系,判断沉淀最大值与HCl的物质的量关系;
C、硫酸中滴入Ba(OH)2的溶液发生氢氧化钡与硫酸的生成硫酸钡沉淀,最后沉淀达最大后不溶解,判断沉淀最大值与氢氧化钡的物质的量关系.
D、石灰水中通入二氧化碳,先发生氢氧化钙与二氧化碳的反应生成醋酸钙沉淀,再发生碳酸钙与二氧化碳、二氧化碳反应,沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系,判断沉淀最大值与二氧化碳的物质的量关系;
E、氯化铝中加入氨水生成氢氧化铝沉淀,沉淀达最大后不能溶解在过量氨水中,判断沉淀最大值与一水合氨的物质的量关系;
F、AlCl3溶液中滴入NaAlO2溶液,发生双水解反应生成氢氧化铝沉淀,最后沉淀达最大后不溶解,根据方程式判断沉淀最大值与偏铝酸钠的物质的量关系;
G、盐酸酸化的AlCl3溶液中滴入KOH溶液,先发生盐酸与氢氧化钠反应,不产生沉淀,然后发生氯化铝与氢氧化钠反应生成氢氧化铝沉淀,沉淀达最大后,发生氢氧化铝与氢氧化钠反应生成偏铝酸钠,最后沉淀完全溶解,根据方程式判断沉淀生成与溶解前后两部分两部分消耗的氢氧化钠的物质的量;
H、AlCl3、MgSO4的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解.
点评:本题以图象为载体考查镁铝化合物的性质,难度中等,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系.
B、NaAlO2溶液中加入稀盐酸,发生反应NaAlO2+HCl+H2O=Al(OH)3↓+NaCl,生成氢氧化铝沉淀,NaAlO2反应完毕后,发生反应,Al(OH)3+3HCl=AlCl3+3H2O,氢氧化铝溶解,前后两部分消耗的盐酸体积为1:3,故图象(1)符合;
C、硫酸中滴入Ba(OH)2的溶液发生氢氧化钡与硫酸的生成硫酸钡沉淀,最后沉淀达最大后不溶解,沉淀最大值与氢氢氧化钡的物质的量之比为1:1,故图象(4)符合;
D、石灰水中通入二氧化碳,先发生Ca(OH)2+CO2═CaCO3↓+H2O,生成沉淀,后发生CO2+CaCO3+H2O═Ca(HCO3)2,沉淀消失,前后两部分二氧化碳的物质的量为1:1,沉淀最大值与二氧化碳的物质的量之比为1:1,故图象(3)符合;
E、氯化铝中加入氨水生成氢氧化铝沉淀,沉淀不能溶解在过量氨水中,发生的反应为Al3++3OH-═Al(OH)3↓,沉淀最大值与一水合氨的物质的量之比为1:3,故图象(5)符合;
F、AlCl3溶液中滴入NaAlO2溶液,发生双水解反应生成氢氧化铝沉淀,最后沉淀达最大后不溶解,发生反应Al3++3AlO2-+6H2O=4Al(OH)3↓,沉淀最大值与偏铝酸钠的物质的量之比为4:3,故图象(6)符合;
G、盐酸酸化的AlCl3溶液中滴入KOH溶液,先发生盐酸与氢氧化钠反应,不产生沉淀,然后发生氯化铝与氢氧化钠反Al3++3OH-═Al(OH)3↓成氢氧化铝沉淀,沉淀达最大后,发生氢氧化铝与氢氧化钠反应Al(OH)3+NaOH═NaAlO2+2H2O沉淀溶解至最后消失,沉淀生成与溶解前后两部分两部分消耗的氢氧化钠的物质的量3:1,故图象(8)符合;
H、AlCl3、MgSO4混合溶液中滴加NaOH溶液发生Al3++3OH-═Al(OH)3↓、Mg2++2OH-═Mg(OH)2↓生成两种沉淀,然后发生Al(OH)3+NaOH═NaAlO2+2H2O,沉淀量减少但不会完全溶解,故图象(7)符合.
故答案为:(1)B; (2)A;(3)D; (4)C; (5)E;(6)F;(7)H;(8)G.
分析:A、氯化铝溶液中加入氢氧化钠溶液先生成沉淀,后沉淀溶解至最后消失,根据方程式判断前后两部分两部分消耗的氢氧化钠物质的量关系,判断沉淀最大值与氢氧化钠的物质的量关系;
B、NaAlO2溶液中加入稀盐酸,先生成氢氧化铝沉淀,后沉淀溶解,根据方程式判断前后两部分两部分消耗的盐酸物质的量关系,判断沉淀最大值与HCl的物质的量关系;
C、硫酸中滴入Ba(OH)2的溶液发生氢氧化钡与硫酸的生成硫酸钡沉淀,最后沉淀达最大后不溶解,判断沉淀最大值与氢氧化钡的物质的量关系.
D、石灰水中通入二氧化碳,先发生氢氧化钙与二氧化碳的反应生成醋酸钙沉淀,再发生碳酸钙与二氧化碳、二氧化碳反应,沉淀消失,根据方程式判断前后两部分二氧化碳的物质的量关系,判断沉淀最大值与二氧化碳的物质的量关系;
E、氯化铝中加入氨水生成氢氧化铝沉淀,沉淀达最大后不能溶解在过量氨水中,判断沉淀最大值与一水合氨的物质的量关系;
F、AlCl3溶液中滴入NaAlO2溶液,发生双水解反应生成氢氧化铝沉淀,最后沉淀达最大后不溶解,根据方程式判断沉淀最大值与偏铝酸钠的物质的量关系;
G、盐酸酸化的AlCl3溶液中滴入KOH溶液,先发生盐酸与氢氧化钠反应,不产生沉淀,然后发生氯化铝与氢氧化钠反应生成氢氧化铝沉淀,沉淀达最大后,发生氢氧化铝与氢氧化钠反应生成偏铝酸钠,最后沉淀完全溶解,根据方程式判断沉淀生成与溶解前后两部分两部分消耗的氢氧化钠的物质的量;
H、AlCl3、MgSO4的混合溶液中加入过量NaOH溶液,先生成氢氧化镁、氢氧化铝两种沉淀,然后氢氧化铝与氢氧化钠反应使沉淀的量减少,但不会完全溶解.
点评:本题以图象为载体考查镁铝化合物的性质,难度中等,明确发生的化学反应是解答的关键,反应发生的先后顺序是学生解答中的难点,注意图象比例关系.

练习册系列答案
 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案
相关题目
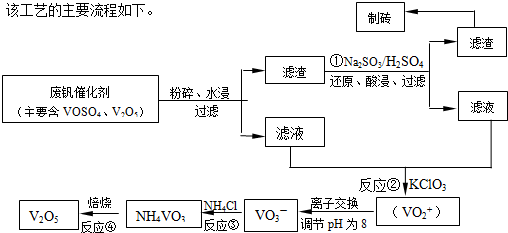
随着材料科学的发展,金属钒及其化合物得到了越来越广泛的应用,并被誉为“合金的维生素”.为回收利用含钒催化剂(含有V2O5、VOSO4及不溶性残渣),科研人员最新研制了一种离子交换法回收钒的新工艺,回收率达91.7%以上.部分含钒物质在水中的溶解性如下表所示:
| 物质 | VOSO4 | V2O5 | NH4VO3 | (VO2)2SO4 |
| 溶解性 | 可溶 | 难溶 | 难溶 | 易溶 |

请回答下列问题:
(1)23V在元素周期表位于第______周期______族.工业上由V2O5冶炼金属钒常用铝热剂法,其用化学方程式表示为______.
(2)反应①的目的是______.
(3)该工艺中反应③的沉淀率(又称沉矾率)是回收钒的关键之一,写出该步发生反应的离子方程式______.
(4)用酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应②后溶液中含钒量,写出配平后完整的离子方程式.
______VO2++______H2C2O4+______H+→______VO2++______ CO2+______.
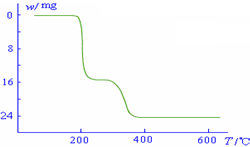
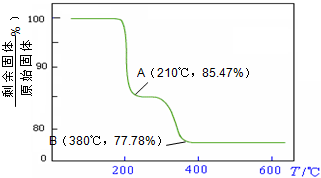
(5)经过热重分析测得:NH4VO3在焙烧过程中,固体质量的减少值(纵坐标)随温度变
 化的曲线如右图所示.则NH4VO3在分解过程中______.
化的曲线如右图所示.则NH4VO3在分解过程中______.A.先分解失去H2O,再分解失去NH3
B.先分解失去NH3,再分解失去H2O
C.同时分解失去H2O和NH3
D.同时分解失去H2、N2和H2O.

 其中a、c二步的化学方程式可表示为
其中a、c二步的化学方程式可表示为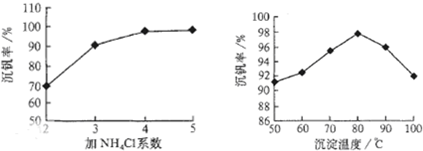
 则NH4VO3在分解过程中
则NH4VO3在分解过程中

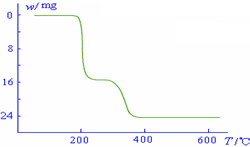 化的曲线如右图所示.则NH4VO3在分解过程中
化的曲线如右图所示.则NH4VO3在分解过程中