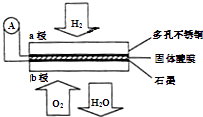
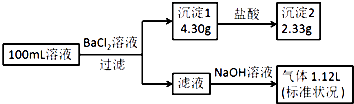
题目内容
【题目】如图为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: 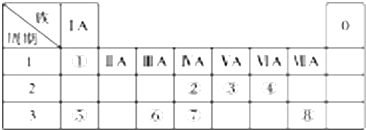
(1)地壳中含量最高的金属元素⑥在周期表中的位置是 .
(2)⑧形成的单质与水反应的离子方程式为 .
(3)②⑦的非金属性强弱可通过比较这两种元素(填编号) a.原子的得电子的能力 b.含氧酸的酸性
c.气态氢化物的稳定性 d.单质的熔沸点
(4)写出一种由④⑤⑧元素形成的既含有离子键又含有共价键的物质的电子式 .
(5)元素⑤与⑧形成的化合物属于(填“离子化合物”、“共价化合物”),用电子式表示该化合物的形成过程: .
【答案】
(1)第3周期ⅢA族
(2)Cl2+H2O ![]() HClO+H++Cl﹣
HClO+H++Cl﹣
(3)ac
(4)![]()
(5)离子化合物;![]()
【解析】解:由短周期元素在周期表的位置可知,①~⑧分别为H、C、N、O、Na、Al、Si、Cl,(1)地壳中含量最高的金属元素⑥在周期表中的位置是第3周期ⅢA族,所以答案是:第3周期ⅢA族;(2)⑧形成的单质与水反应的离子方程式为Cl2+H2O ![]() HClO+H++Cl﹣ , 所以答案是:Cl2+H2O
HClO+H++Cl﹣ , 所以答案是:Cl2+H2O ![]() HClO+H++Cl﹣;(3)a.原子的得电子的能力可比较非金属性,故a选; b.含氧酸的酸性不一定为最高价含氧酸,不能比较非金属性,故b不选;c.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性可比较非金属性,故c选; d.单质的熔沸点,为物理性质,不能比较非金属性,故d不选;所以答案是:a c;(4)由④⑤⑧元素形成的既含有离子键又含有共价键的物质NaClO,其电子式为
HClO+H++Cl﹣;(3)a.原子的得电子的能力可比较非金属性,故a选; b.含氧酸的酸性不一定为最高价含氧酸,不能比较非金属性,故b不选;c.非金属性越强,对应氢化物越稳定,则气态氢化物的稳定性可比较非金属性,故c选; d.单质的熔沸点,为物理性质,不能比较非金属性,故d不选;所以答案是:a c;(4)由④⑤⑧元素形成的既含有离子键又含有共价键的物质NaClO,其电子式为 ![]() ,所以答案是:
,所以答案是: ![]() ;(5)元素⑤与⑧形成的化合物为NaCl,为离子化合物,用电子式表示该化合物的形成过程为
;(5)元素⑤与⑧形成的化合物为NaCl,为离子化合物,用电子式表示该化合物的形成过程为 ![]() ,所以答案是:离子化合物;
,所以答案是:离子化合物; ![]() .
.

【题目】甲、乙两化学兴趣小组安装两套如图1相同装置,用以探究影响H2O2分解速率的因素. 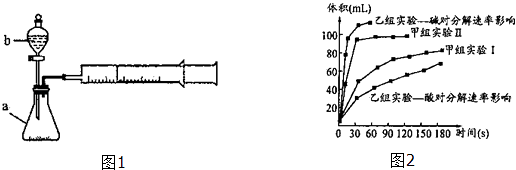
(1)仪器b的名称: .
(2)甲小组有如下实验设计方案,请帮助完成下列填空.
实验编号 | 实验目的 | t℃ | 催化剂 | 浓度 |
甲组实验Ⅰ | 做实验参照 | 25 | 10mL 2%H2O2 | |
甲组实验Ⅱ | 探究浓度对速率的影响 | 25 | 10mL 5%H2O2 |
(3)甲、乙两小组得出如图2数据. ①由甲组实验得出的数据可知:浓度越大,H2O2分解速率(填“越快”、“越慢”);
②由乙组研究的酸、碱对H2O2分解影响因素的数据分析相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是;
③乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2 , 其化学反应方程式为;支持这一方案的理由是 .