题目内容
20.X、Y、Z、W为四种短周期主族元素.其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6.下列说法正确的是( )| A. | X与W可以形成W2X、W2X2两种化合物 | |
| B. | Y元素最高价氧化物对应水化物的化学式为H2YO4 | |
| C. | Z元素的非金属性比X元素的非金属性强 | |
| D. | Y、Z两元素的简单离子的半径Y>Z |
分析 X、Y、Z、W为四种短周期主族元素,X原子最外层电子数是核外电子层数的3倍,则X为O元素,X、Z同族,则Z为S元素;
Y的最高正价与最低负价的代数和为6,则Y的最高价为+7价,且与硫同周期,所以Y为Cl元素;
W与X、Y既不同族也不同周期,W为H元素,根据元素周期律的递变规律,再结合选项判断.
解答 解:X、Y、Z、W为四种短周期主族元素,X原子最外层电子数是核外电子层数的3倍,则X为O元素,X、Z同族,则Z为S元素;
Y的最高正价与最低负价的代数和为6,则Y的最高价为+7价,且与硫同周期,所以Y为Cl元素;
W与X、Y既不同族也不同周期,W为H元素,
A.W为H、X为O,可形成H2O、H2O2,故A正确;
B.Y为Cl元素,最高价氧化物对应水化物的化学式为HClO4,故B错误;
C.Z为S元素、X为O元素,O元素的非金属性较强,故C错误;
D.Y为Cl元素、Z为S元素,S的离子半径较大,故D错误.
故选A.
点评 本题考查位置结构性质的相互关系应用,题目难度不大,本题注意把握如何从化合价的角度推断元素的种类,学习中注重把握元素周期律的主要内容.

练习册系列答案
 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案
相关题目
11.下列关于胶体的叙述正确的是( )
| A. | 向煮沸的稀NaOH溶液中滴加饱和FeCl3溶液配制Fe(OH)3胶体 | |
| B. | 丁达尔效应是区别胶体和溶液的一种常用物理方法 | |
| C. | 胶体中的分散质粒子大小在1~10nm之间 | |
| D. | 可以用过滤的方法将胶体和溶液分离 |
8.下列反应的离子方程式书写正确的是( )
| A. | 钠和水反应Na+H2O═Na++OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液 Al+2OH-═AlO2-+H2↑ | |
| C. | 金属铝溶于盐酸中:Al+6H+═Al3++3H2↑ | |
| D. | FeCl2溶液中加入氯水:Cl2+2Fe2+═2Fe3++2Cl- |
12.有机化学在日常生活中应用广泛,下列有关说法正确的是( )
| A. | 相同条件下,新戊烷、异戊烷、正丁烷的沸点依次增大 | |
| B. | 苯与甲苯互为同系物,均能使KMnO4酸性溶液褪色 | |
| C. | 甲苯和Cl2光照下的反应与乙醇和乙酸的反应属于不同类型的反应 | |
| D. | 有芳香气味的C9H18O2在酸性条件下加热可水解产生相对分子质量相同的两种有机物,则符合此条件的C9H18O2的结构有16种 |
9.下列叙述不正确的是( )
| A. | 铝制容器可盛装冷的浓硫酸 | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-═2AlO2-+H2O | |
| C. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| D. | 日用铝制品表面覆盖着氧化膜,对内部金属起保护作用,所以能用铝制容器存放盐酸 |
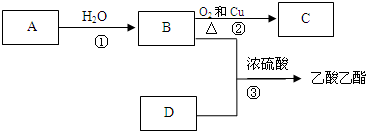
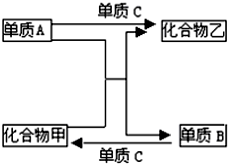 A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些化合物和单质之间存在如下图所示的关系.据此判断:
A、B、C是三种短周期元素的单质,甲、乙是两种常见的化合物.这些化合物和单质之间存在如下图所示的关系.据此判断: