题目内容
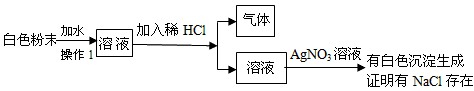
现有一包白色粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CuSO4,进行如下实验①溶于水得无色溶液;②向溶液中加入BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失,据上述实验现象推断:一定不存在___________,一定存在_____________,可能存在_________,对于可能存在的物质应如何近一步检验?写出简要的步骤和有关的离子方程式。
CaCO3、CuSO4、Na2SO4; Na2CO3; NaCl
取无色溶液少量放于试管中,滴加足量的稀HNO3,待气泡放尽后,滴加AgNO3试剂,看是否产生白色沉淀。若有,则含有NaCl,反之则无。
CO32-+2H+=CO2↑+H2O
Ag+ +Cl- = AgCl↓
【解析】
试题分析:步骤①白色粉末溶于水得到无色溶液,可得一定不存在CaCO3、CuSO4;步骤②说明一定不存在Na2SO4,一定存在Na2CO3;对于NaCl的存在与否,则是一种可能性。
对于可能存在物质的确定,实际上就是考查对氯离子的检验,此时应注意溶液中存在碳酸根离子的干扰,应排除干扰。而氯离子的检验所用的试剂为AgNO3试剂。描述时应注意语言的规范性,详细见答案。
考点:离子反应
点评:本题是对混合物组成成分确定的考查。对于此类题目的解答在于熟练掌握各物质的基本性质。如颜色、状态;或者某些特征反应。
如:①水能使无水硫酸铜变蓝;②CO2能使澄清石灰水变浑浊;③O2能使带火星的木条复燃;
④Fe2+:浅绿色;Fe3+黄色;Cu2+:蓝色;MnO4-:紫红色
⑤掌握常见离子的检验:
⑥注意用语规范;如:对于气体,应使用“将气体通入······”或者“将气体导入到······”;
对于液体,应取样进行实验。如“取少量溶液与试管中,········”
对于实验操作及现象的描述:“去少量溶液于试管中,滴加····,若观察到···,则说明····;若没有···现象,则说明·······”

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案已知Na2SO3在空气中易被氧化为Na2SO4,现有一包包装破损的白色Na2SO3固体粉末,为了检验其是否变 质,正确的方法是
质,正确的方法是
| A.取少量样品于试管中,滴入稀盐酸,无沉淀,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。 |
| B.取少量样品于试管中,滴入稀硝酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。 |
| C.取少量样品于试管中,滴入稀硫酸,再滴入BaCl2溶液,若有白色沉淀产生,则说明已变质。 |
| D.取少量样品于试管中,滴入稀盐酸,若产生使品红溶液褪色的气体,则说明已变质 |