题目内容
已知氨水的电离度与醋酸的电离度(即电离程度大小)在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。甲同学的解释是Mg(OH)2(s)![]() Mg2++2OH- ①
Mg2++2OH- ①
![]() +H2O
+H2O![]() NH3·H2O+H+ ②
NH3·H2O+H+ ②
H++OH-![]() H2O ③
H2O ③
由于![]() 水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是
Mg(OH)2(s)![]() Mg2++2OH- ①
Mg2++2OH- ①
![]() +OH-
+OH-![]() NH3·H2O ②
NH3·H2O ②
由于NH4Cl电离出的![]() 与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是_________(填写编号)。
A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3·H2O
(2)你说明丙同学做出该选择的理由:______________________________。
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理_____________(填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式_____________________________________。
(1)B (2)CH3COONH4溶液呈中性;滴入Mg(OH)2悬浊液,若Mg(OH)2悬浊液溶解,则说明乙同学解释正确,若Mg(OH)2不溶,则甲同学解释正确 (3)乙Mg(OH)2+2![]() ====Mg2++2NH3·H2O
====Mg2++2NH3·H2O
解析:本题为分析评价题,应综合运用溶解平衡、水解平衡及电离平衡等知识。甲、乙两同学争论的焦点就是究竟是![]() 水解显酸性的作用还是
水解显酸性的作用还是![]() 与OH-结合成NH3·H2O的作用,因此要证明甲、乙谁正确,就得选择水解不显酸性的铵盐,CH3COONH4溶液呈中性,可选用CH3COONH4作试剂。
与OH-结合成NH3·H2O的作用,因此要证明甲、乙谁正确,就得选择水解不显酸性的铵盐,CH3COONH4溶液呈中性,可选用CH3COONH4作试剂。

 名校课堂系列答案
名校课堂系列答案( 8分)已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性。现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解。
甲同学的解释是:Mg(OH)2(固)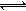 Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①
NH4++H2O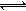 NH3·H2O +H+…………② H++OH―
NH3·H2O +H+…………② H++OH―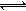 H2O…………③
H2O…………③
由于NH4+水解显酸性,H+与OH―反应生成水,导致反应①平衡右移,沉淀溶解;
乙同学的解释是:Mg(OH)2(固)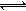 Mg2+(aq)+2OH—(aq)……① NH4++OH―
Mg2+(aq)+2OH—(aq)……① NH4++OH―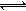 NH3·H2O……②
NH3·H2O……②
由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH―结合,生成了弱的电解质NH3·H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解。
(1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 (填写编号)。
| A.NH4NO3 | B.CH3COONH4 | C.Na2CO3 | D.NH3·H2O |
(3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊液溶解的离子方程式 。
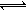 Mg2+(aq)+2OH—(aq)…………①
Mg2+(aq)+2OH—(aq)…………①