题目内容
25℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ/mol、285.8 kJ/mol、890.3一kJ/mol、2800 kJ/mol。则下列热化学方程式正确的是
A.C(s)+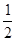 O2(g)=CO(g);△H=" -" 393.5 kJ/mol O2(g)=CO(g);△H=" -" 393.5 kJ/mol |
| B.2H2(g)+O2(g)=2H2O(l);△H="+571.6" kJ/mol |
| C.CH4(g)+CO2(g)=CO2(g)+2H2O(g);△H=-890.3 kJ/mol |
D.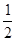 C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H="-1400" kJ/mol C6H12O6(s)+3O2(g)=3CO2(g)+3H2O(l);△H="-1400" kJ/mol |
D
解析试题分析:燃烧热的概念是,在一定条件下,1摩尔可燃物完全燃烧生成稳定的氧化物所放出的热量。A项,生成了CO,错误。B项,是吸热,错误。C项,生成的是气态水,错误。D项,符合燃烧热的概念,正确。
考点:燃烧热。本题考察学生对燃烧热的理解和掌握。

练习册系列答案
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案
相关题目
肼(N2H4)是火箭发动机的一种燃料,反应时N2O4为氧化剂,生成N2和水蒸气。已知:
N2(g)+2O2(g)=N2O4(g) ΔH="+8.7" kJ·mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g) ΔH="-534.0" kJ·mol-1
下列表示肼跟N2O4反应的热化学方程式,正确的是
| A.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-542.7" kJ·mol-1 |
| B.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1059.3" kJ·mol-1 |
C.N2H4(g)+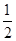 N2O4(g)= N2O4(g)=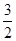 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 N2(g)+2H2O(g) ΔH="-1076.7" kJ·mol-1 |
| D.2N2H4(g)+N2O4(g)=3N2(g)+4H2O(g) ΔH="-1076.7" kJ·mol-1 |
某废水处理厂处理废水中NH+的过程如下:
①NH4+(aq)+ O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
O2(g)=HNO2(aq)+H+(aq)+H2O(1) ΔH="-b" KJ/mol
②2HNO2(aq)+O2(g)=2NO3-(aq)+2H+ ΔH=-aKJ/mol
下列叙述正确的是( )
| A.将NH4+转化为NO3-的热化学方程式可表示为: NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(1)ΔH=-(b+  )KJ/mol )KJ/mol |
| B.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱 |
| C.常温下,若HNO3溶液中c(H+)="0.1" mol·L-1,则该溶液的pH>1 |
| D.若上述两次转化完全,不考虑其它杂质离子的存在,则:c(NH4+)+c(OH-)=c(NO3-)+c(H+) |
铁和稀硫酸在敞口容器中进行反应: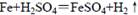 ,下列叙述中不正确的是
,下列叙述中不正确的是
A.该反应的反应过程与能量关系可以用下图表示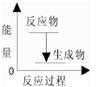 |
| B.若将该反应设计成原电池,当正极产生22.4L气体时,有56g铁溶解 |
| C.若将该反应设计成原电池,溶液中SO42-向Fe电极移动 |
| D.若将该反应设计成原电池,负极发生的反应是:Fe -2e =Fe2+ |
关于化学能与热能的叙述,正确的是( )
| A.1mol酸与碱恰好中和时所放出的热量叫中和热 |
| B.化学反应中的能量变化,主要是由化学键的变化引起的 |
| C.燃料电池反应时,化学能降低 |
| D.反应物的总能量高于生成物总能量的反应,不需要加热就可自行反应 |
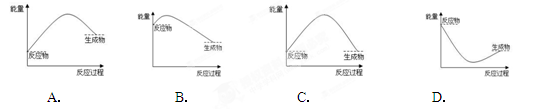
下列关于反应过程中能量变化的说法正确的是
| A.图中a、b曲线可分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g) ΔH<0使用和未使用催化剂时,反应过程中的能量变化 |
| B.己知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2。则ΔH1>ΔH2 |
| C.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同 |
| D.在一定条件下,某可逆反应的ΔH=+100kJ·mol-1,则该反应正反应活化能比逆反应活化能大100kJ·mol-1 |

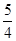 O2(g)=
O2(g)= P4O10(s);Δ H=-738.5KJ·mol-1
P4O10(s);Δ H=-738.5KJ·mol-1