题目内容
【题目】阿立哌唑E(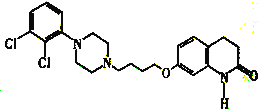 )是新型非典型抗精神病药物,被誉为“多巴胺系统稳定剂”,可由以下路线合成:
)是新型非典型抗精神病药物,被誉为“多巴胺系统稳定剂”,可由以下路线合成:
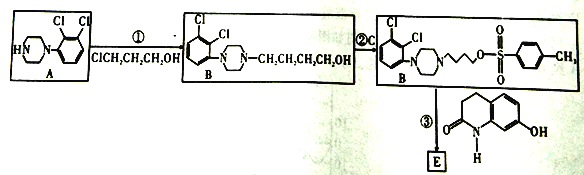
其中C是一种有机强酸。请回答下列问题:
(1)所发生的反应中属于取代反应的是____________(填序号)。
(2)写出B生成D的化学方程式是____________。
(3)E的分子式为____________。
(4)已知F:①与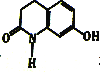 水解的产物互为同分异构体;②属于α一氨基酸;③苯环上有两个取代基;④核磁共振氢谱图中有6个峰;⑤能与FeCl3溶液发生显色反应。F的结构简式为_______。
水解的产物互为同分异构体;②属于α一氨基酸;③苯环上有两个取代基;④核磁共振氢谱图中有6个峰;⑤能与FeCl3溶液发生显色反应。F的结构简式为_______。
(5)已知:R-CHO![]()
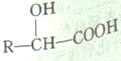 。合成路线流程图示例:
。合成路线流程图示例:
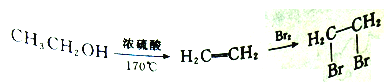
①ClCH2CH2CH2CH2OH的系统命名是_____________。
②写出由ClCH2CH2CH2CH2OH制备化合物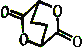 的合成路线流程图(无机试剂任选)。_____________
的合成路线流程图(无机试剂任选)。_____________
【答案】 ①②③ 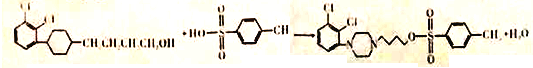 C23H28N3O2Cl2
C23H28N3O2Cl2 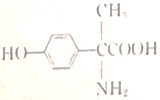 4-氯-1-丁醇
4-氯-1-丁醇 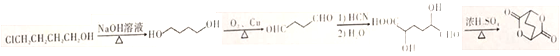
【解析】(1)由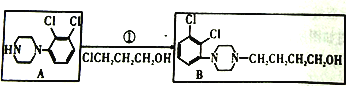 知发生的反应中属于取代反应,由
知发生的反应中属于取代反应,由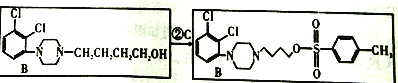 知为取代反应
知为取代反应
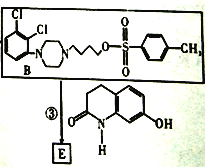 E的结构简式为:
E的结构简式为: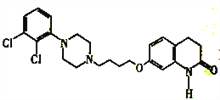
所以也是发生的取代反应。答案:①②③
(2)由 B生成D的化学方程式是
B生成D的化学方程式是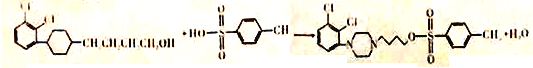
(3)E的结构简式 其分子式为:C23H28N3O2Cl2
其分子式为:C23H28N3O2Cl2
(4)①ClCH2CH2CH2CH2OH的系统命名是4-氯-1-丁醇。
②由ClCH2CH2CH2CH2OH制备化合物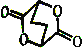 的合成路线流程图为:
的合成路线流程图为:

【题目】游离态碳在自然界存在形式有多种,在工业上有着重要用途。请回答下列问题:
(1)我国四大发明之一的黑火药由木炭与硫黄、硝酸钾按一定比例混合而成。黑火药爆炸时生成硫化钾、氮气和二氧化碳。其爆炸的化学方程式为_____________________________________。
(2)高级碳粉可由烃类高温分解而制得,已知几个反应的热化学方程式:
C(s)+O2(g)==CO2(g) △H1= -393.5 kJmol-1
2H2(g)+O2(g)=2H2O(1) △H2= -571.6 kJmol-1
CH4(g)+2O2(g)-=CO2(g)+ 2H2O(1) △H3= -890.3 kJmol-1
则由天然气生产高级碳粉的热化学方程式为__________________________________。
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1L闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=________(保留两位小数)。10-20min内,NO的平均反应速率为_______________;若30min后升高温度,达到新平衡时,容器中c(NO)∶c(N2) ∶c(CO2)=2∶1∶1,则该反应的ΔH________0(填“>”、“<”或“=”)。
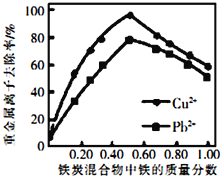
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是_________________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是___________________________。