题目内容
短周期元素形成的常见非金属固体单质A与常见金属单质B,在加热条件下反应生成化合物C,C与水反应生成白色沉淀D和气体E,D既能溶于强酸,也能溶于强碱。E在足量空气中燃烧产生刺激性气体G,G在大气中能导致酸雨的形成。E被足量氢氧化钠溶液洗后得到无色溶液F,溶液F在空气中长期放置发生反应,生成物之一为H。H与过氧化钠的结构和化学性质相似,其溶液显黄色。请回答下列问题:
(1)组成单质A的元素在周期表中的位置是 。
(2)组成单质B的元素的原子结构示意图为 。
(3)G与氯酸钠在酸性条件下反应可生成消毒杀菌剂二氧化氯,该反应的氧化剂为 。
(4)溶液F在空气中长期放置生成H的化学方程式为 。
(5)H的溶液与稀硫酸反应产生的现象为 。
(1)第三周期第ⅥA族
(2)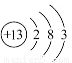
(3)氯酸钠(NaClO3)
(4)4Na2S+O2+2H2O=4NaOH+2Na2S2
(或2Na2S+O2+2H2O=4NaOH+2S↓,Na2S+S=Na2S2)
(5)溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体
【解析】根据白色沉淀D既能溶于强酸,也能溶于强碱,确定D为两性氢氧化物Al(OH)3,从而确定非金属固体单质A为S,金属单质B为Al,C为Al2S3、E为H2S、F为Na2S、G为SO2。
(1)S在元素周期表中的位置为第三周期第ⅥA族。
(2)Al的原子结构示意图为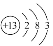
(3)SO2与NaClO3在酸性条件下反应生成ClO2,从化合价的角度分析可知,Cl元素的化合价从+5价降低到+4价,所以NaClO3为氧化剂。
(4)Na2S在空气中长期放置产物与Na2O2的结构类似,则H的化学式应为Na2S2,根据元素守恒和电荷守恒可知Na2S反应生成Na2S2的化学方程式为4Na2S+O2+2H2O=2Na2S2+4NaOH。
(5)根据Na2O2与H2SO4反应的方程式为2Na2O2+2H2SO4=2Na2SO4+O2↑+2H2O可知,Na2S2与H2SO4反应的方程式应为2Na2S2+2H2SO4=2Na2SO4+2S↓+2H2S↑,所以现象为溶液由黄色变为无色,产生浅黄色沉淀和臭鸡蛋气味的气体。








