题目内容
一定条件下,体积为2L的密闭容器中,1mol A和1mo1 B进行反应:
A(g)+3B(g)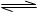 2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
下列说法正确的是 ( )
A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
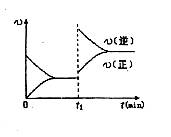
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
A(g)+3B(g)
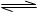 2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。
2C(g) 经2分钟反应达到平衡,此时生成0.2mol C。下列说法正确的是 ( )

A.反应开始至2分钟时,以B浓度变化表示的反应速率为0.05mol/(L.min)
B.反应开始至2分钟时,A的转化率为5%
C.若其他条件不变,升高温度,A的体积分数增大,则该反应的△H<0
D.若其他条件不变,增大压强,化学反应速率的变化符合右侧示意图
C
解本题学生应明确化学反应速率的基本公式V=△C÷△t 和化学反应速率的表示规律;外在条件对化学平衡移动方向的影响。
知有反应 A(g)+3B(g)
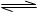 2C(g)
2C(g)始 1 2 0 mol
2分钟末 1-0.1 2-0.3 0.2 mol
变化 0.1 0.3 0.2 mol
A应为:V(B)=
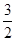 V(C)=
V(C)= 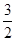 ×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1
×(0.2÷2)÷2 =" 0.075" mol.L-1.min-1B应为:2分钟末A的转化率为 =
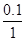
 100% =" 10%"
100% =" 10%" C:正确。升高温度从图中可见:逆反应速率增大的倍数大于正反应速率增大的倍数,平衡向逆反应方向移动,即逆反应吸热,正反应放热。
D:错误,本反应反应物气体系数和为4,生成物气体系数为2,增大压强平衡向气体体积减小的方向移动。应为,正反应速率增大的倍数大于逆反应速率增大的倍数。

练习册系列答案
相关题目
 PCl3(g)+Cl2(g),反应达到平衡时,PCl3在混合气体中的体积分数为m%,保持温度和容积不变,再加入1mol PCl5,反应达到平衡时,PCl3在混合气体中的体积分数为n%,则m和n的关系正确的是( )
PCl3(g)+Cl2(g),反应达到平衡时,PCl3在混合气体中的体积分数为m%,保持温度和容积不变,再加入1mol PCl5,反应达到平衡时,PCl3在混合气体中的体积分数为n%,则m和n的关系正确的是( ) 2 SO3反应。进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为( )
2 SO3反应。进行到4mi n时,测得SO2为0.4mol,若反应进行到2min时,容器中的SO2为( ) HCl+HClO达平衡时,欲使HClO浓度增大,应加入( )
HCl+HClO达平衡时,欲使HClO浓度增大,应加入( ) 2C(g)的下列叙述中,能说明反应已达到平衡的是( )
2C(g)的下列叙述中,能说明反应已达到平衡的是( ) 2NH3(g);△H<0 。
2NH3(g);△H<0 。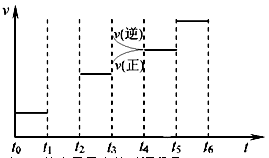
 2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据:
2NO2(g)△H=" +57" kJ·mol-1,隔一段时间对该容器内的物质进行分析,得到如下数据: